题目内容
将过量的SO2气体通入下列溶液中,最终没有沉淀的是( )
| A、Na[Al(OH)4] |
| B、BaCl2 |
| C、Ba(NO3)2 |
| D、Na2SiO3 |
考点:二氧化硫的化学性质
专题:氧族元素
分析:盐酸的酸性大于亚硫酸,结合酸性的比较及发生的氧化还原反应判断生成的沉淀,以此来解答.
解答:
解:A.亚硫酸的酸性大于氢氧化铝的酸性,则过量SO2气体通入Na[Al(OH)4]中生成氢氧化铝沉淀,故A不选;
B.过量的SO2气体与BaCl2不反应,不能生成沉淀,故B选;
C.过量的SO2气体通入Ba(NO3)2溶液中,发生氧化还原反应生成硫酸钡沉淀,故C不选;
D.亚硫酸的酸性大于硅酸,则过量的SO2气体通入Na2SiO3溶液中生成硅酸沉淀,故D不选;
故选B.
B.过量的SO2气体与BaCl2不反应,不能生成沉淀,故B选;
C.过量的SO2气体通入Ba(NO3)2溶液中,发生氧化还原反应生成硫酸钡沉淀,故C不选;
D.亚硫酸的酸性大于硅酸,则过量的SO2气体通入Na2SiO3溶液中生成硅酸沉淀,故D不选;
故选B.
点评:本题考查二氧化硫的化学性质,为高频考点,把握酸性的比较急发生的氧化还原反应为解答的关键,侧重二氧化硫酸性氧化物及还原性的考查,题目难度不大.

练习册系列答案
相关题目
下列说法正确的是( )
| A、易溶于水的物质一定是电解质 |
| B、与酸反应生成盐和水的物质一定是碱 |
| C、氧化还原反应中的某一物质不可能同时既被氧化又被还原 |
| D、丁达尔效应是区别胶体和溶液的一种常用物理方法 |
在体积为100ml的密闭容器中,放入反应物A和B,在不同的温度下发生反应:2A(s)+B(g)?2C(g),得到该反应平衡常数与温度的关系如表所示.
下列说法正确的是( )
| 温度℃ | 25 | 80 | 230 |
| 平衡常数 | 5×104 | 2 | 1.9×10-5 |
| A、加热平衡向右移动 |
| B、25℃时反应2C?2A(s)+B(g)的平衡常数为0.5 |
| C、在80℃时,测得某时刻,B、C浓度均为0.5mol/L,则此时v(正)>v(逆) |
| D、80℃达到平衡时,再投入一定量的A,平衡正向移动 |
下列物质中,是强电解质的是( )
| A、二氧化碳气体 | B、固体氯化钠 |
| C、蔗糖溶液 | D、盐酸 |
不能用化学平衡移动原理来说明的事实是( )
| A、合成氨在高压下进行是有利的 |
| B、温度过高对合成氨不利 |
| C、使用催化剂能使合成氨速率加快 |
| D、及时分离从合成塔中出来的混合气,有利于合成氨 |
下列叙述正确的是( )
| A、利用丁达尔效应可以区别溶液与胶体 |
| B、直径介于1nm~10nm之间的微粒称为胶体 |
| C、电泳现象可证明胶体带电 |
| D、胶体粒子可以透过半透膜而不能透过滤纸 |
已知铅+2价稳定,+4价铅有很强的氧化性,今有6种下列物质:H2O、PbO2、Pb(NO3)2、HMnO4、HNO3和Mn(NO3)2组成一个化学方程式.下列有关说法正确的是( )
| A、反应物中发生氧化反应的物质PbO2 |
| B、被还原的元素是Mn(NO3)2中Mn |
| C、反应中1mol氧化剂得到5mol电子 |
| D、请将反应物配平后的PbO2与Mn(NO3)2系数之比5:2 |
溴酸银(AgBrO3)溶解度随温度变化曲线如图所示,下列说法错误的是( )
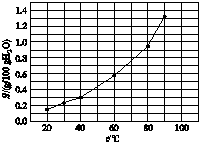

| A、60℃时溴酸银的Ksp约等于6×10-4 |
| B、温度升高时溴酸银溶解速度加快 |
| C、溴酸银的溶解时放热过程 |
| D、若硝酸钾中含有少量溴酸银,可用重结晶方法提纯 |
下列说法正确的是( )
A、按系统命名法, 的名称为2,4,5-三甲基己烷 的名称为2,4,5-三甲基己烷 |
B、分子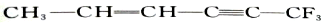 中,位于同一平面上碳原子最多有6个 中,位于同一平面上碳原子最多有6个 |
C、化合物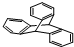 是苯的同系物 是苯的同系物 |
| D、3-甲基-3-乙基戊烷的一氯取代产物有6种 |