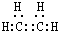题目内容
20.Na2CO3•XH2O是一种使用广泛的化学试剂,某化学兴趣小组通过下列实验测定某试样中Na2CO3•XH2O的含量.(1)称取3.20g试样溶于蒸馏水配成100mL溶液,从中取出10.00mL溶液于锥形瓶中,加2滴甲基橙指示剂,用0.100mol/L盐酸滴定至终点,共消耗盐酸20.00mL(杂质不与酸反应),求试样中Na2CO3•xH2O的物质的量.
(2)另取同样质量的该试样加热至失去全部结晶水(杂质不分解),经恒重操作后,称得质量为1.4g,求Na2CO3•xH2O中的X值.
(3)试样中Na2CO3•xH2O的质量分数.
分析 (1)根据:Na2CO3•xH2O~2HCl分析解答;
(2)经恒重操作后,称得质量为1.4g,所以结晶水的质量为:3.20g-1.4g=1.8g,物质的量为0.1mol,而由(1)可知Na2CO3•xH2O的物质的量为0.01mol,所以x=$\frac{0.1}{0.01}$=10;
(3)试样中Na2CO3•xH2O的质量分数=$\frac{10水碳酸钠的质量}{样品的质量}×100%$.
解答 解:(1)用0.100mol/L盐酸滴定至终点,共消耗盐酸20.00mL,则消耗盐酸的物质的量为:0.1×20×10-3=2×10-3mol,由Na2CO3•xH2O~2HCl可知试样中Na2CO3•xH2O的物质的量为:$\frac{2×1{0}^{-3}}{2}×\frac{100}{10}$=0.01mol,答:试样中Na2CO3•xH2O的物质的量0.01mol;
(2)经恒重操作后,称得质量为1.4g,所以结晶水的质量为:3.20g-1.4g=1.8g,物质的量为0.1mol,而由(1)可知Na2CO3•xH2O的物质的量为0.01mol,所以x=$\frac{0.1}{0.01}$=10,答:Na2CO3•xH2O中的X值为10;
(3)试样中Na2CO3•xH2O的质量分数=$\frac{10水碳酸钠的质量}{样品的质量}×100%$=$\frac{0.01×286g}{3.20g}×100%$=89.38%,答:试样中Na2CO3•xH2O的质量分数为:89.38%.
点评 本题考查根据方程式的有关计算以及质量分数的计算等,难度不大,根据所学知识即可完成.

练习册系列答案
相关题目
10. 五种常见物质X、Y、Z、E、F均含有同一元素M,已知Y是单质,Z是NO(一氧化氮),在一定条件下它们有如下转化关系,下列推断不合理的是( )
五种常见物质X、Y、Z、E、F均含有同一元素M,已知Y是单质,Z是NO(一氧化氮),在一定条件下它们有如下转化关系,下列推断不合理的是( )
 五种常见物质X、Y、Z、E、F均含有同一元素M,已知Y是单质,Z是NO(一氧化氮),在一定条件下它们有如下转化关系,下列推断不合理的是( )
五种常见物质X、Y、Z、E、F均含有同一元素M,已知Y是单质,Z是NO(一氧化氮),在一定条件下它们有如下转化关系,下列推断不合理的是( )| A. | X可能是一种氢化物 | B. | M不可能是金属 | ||
| C. | E可能是一种有色气体 | D. | X→Y一定是氧化还原反应 |
12.能形成离子键的是( )
| A. | 任何金属元素与非金属元素之间的化合 | |
| B. | 任意两种元素之间的化合 | |
| C. | 典型活泼金属和典型活泼非金属之间的化合 | |
| D. | 两种非金属元素之间的化合 |
9.将1.0体积的两种烃的混合气体在氧气中充分燃烧,生成2.4体积的CO2和2.8体积的水蒸气(同温同压下),则混合物中的两种烃可能是( )
| A. | 乙烯和丙烷 | B. | 甲烷和丙烷 | C. | 甲烷和丙烯 | D. | 乙烯和丁烷 |
10.下列说法正确的是( )
| A. | 自然界中所有金属都以化合态形式存在 | |
| B. | 化学史上,金、银、铜发现较早,钾、钠、铝发现较迟是因为前者自然界含量高,后者含量低 | |
| C. | 废旧金属处理的最好办法是深埋 | |
| D. | 冶炼金属的一般步骤是:浮选富集→冶炼→精炼 |
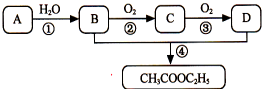 已知气态烃A是一种基本的有机化工原料,目前石油裂解已成为生成A的主要方法.A在标准状况下的密度为1.25g•L-1.A、B、C、D在一定条件下存在如下转化关系(反应条件、部分产物被省略).请回答下列问题:
已知气态烃A是一种基本的有机化工原料,目前石油裂解已成为生成A的主要方法.A在标准状况下的密度为1.25g•L-1.A、B、C、D在一定条件下存在如下转化关系(反应条件、部分产物被省略).请回答下列问题: