题目内容
8.下列说法正确的是( )| A. | 因为SO2具有漂白性,所以它能使品红溶液、溴水、KMnO4(H+)、石蕊溶液褪色 | |
| B. | 能使品红溶液褪色的不一定是SO2 | |
| C. | SO2、漂白粉、活性炭、Na2O2都能使红墨水褪色,其原理相同 | |
| D. | SO2和Cl2等物质的量混合后同时通入装有湿润的有色布条的集气瓶中,漂白效果更好 |
分析 A、SO2使溴水、KMnO4(H+)褪色是利用了还原性,使品红褪色是由于漂白性;
B、能使品红褪色的物质有很多,不仅仅是SO2,还有氯气等;
C、活性炭是吸附漂白,漂白粉、Na2O2是氧化漂白,SO2是生成不稳定的无色物质;
D、SO2和Cl2等物质的量混合后在溶液中发生反应:SO2+Cl2+2H2O═H2SO4+2HCl,两者都没有漂白能力.
解答 解:A、SO2使溴水、KMnO4(H+)褪色是利用了还原性,使品红褪色是由于漂白性,SO2不能使指示剂褪色,故A错误;
B、能使品红褪色的物质有很多,不仅仅是SO2,还有氯气等,所以能使品红溶液褪色的不一定是SO2,故B正确;
C、活性炭是吸附漂白,漂白粉、Na2O2是氧化漂白,SO2是生成不稳定的无色物质,所以其原理不相同,故C错误;
D、SO2和Cl2等物质的量混合后在溶液中发生反应:SO2+Cl2+2H2O═H2SO4+2HCl,从而失去漂白能力,所以漂白效果减弱,故D错误;
故选B.
点评 本题考查物质的漂白性,侧重考查基本原理,知道二氧化硫具有漂白性、还原性,知道哪些方面体现还原性、哪些方面体现漂白性,易错选项是A.

练习册系列答案
 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案
相关题目
18.用Cl2生产某些含氯有机物时会产生副产物HCl,利用反应4HCl+O2$?_{400℃}^{CuO/CuCl_{2}}$2Cl2+2H2O可实现氯的循环利用.已知:
Ⅰ.反应中,4 mol HCl被氧化放出115.6 kJ 的热量;
Ⅱ.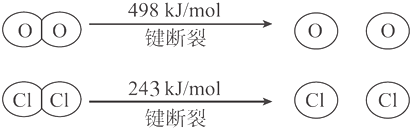
则断开1molH-O键与断开1molH-Cl键所需能量相差约为( )
Ⅰ.反应中,4 mol HCl被氧化放出115.6 kJ 的热量;
Ⅱ.

则断开1molH-O键与断开1molH-Cl键所需能量相差约为( )
| A. | 12kJ | B. | 32kJ | C. | 115.6kJ | D. | 127.6kJ |
19.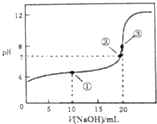 常温下,用0.1000mol•L-1NaOH溶液滴定20.00mL0.1000mol•L-1CH3COOH溶液所得曲线如图.下列说法正确的是( )
常温下,用0.1000mol•L-1NaOH溶液滴定20.00mL0.1000mol•L-1CH3COOH溶液所得曲线如图.下列说法正确的是( )
 常温下,用0.1000mol•L-1NaOH溶液滴定20.00mL0.1000mol•L-1CH3COOH溶液所得曲线如图.下列说法正确的是( )
常温下,用0.1000mol•L-1NaOH溶液滴定20.00mL0.1000mol•L-1CH3COOH溶液所得曲线如图.下列说法正确的是( )| A. | 滴定过程中可能出现:c(CH3COOH)>c(CH3COO-)>c(H+)>c(Na+)>c(OH-) | |
| B. | ①处水的电离程度大于②处水的电离程度 | |
| C. | ②处加入的NaOH溶液恰好将CH3COOH中和 | |
| D. | ③处所示溶液:c(Na+)<c(CH3COO-) |
3.下列说法不正确的是( )
| A. | 粗铜电解精炼时,应将粗铜与直流电源的正极相连 | |
| B. | 金属的吸氧腐蚀的过程中,正极的电极反应式为O2+4e-+2H2O═4OH- | |
| C. | 燃料电池中加入燃料的电极一定是电池的负极 | |
| D. | 在生产生活中,为保护钢铁器件免受腐蚀,应将该器件与直流电源的正极相连 |
20.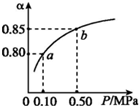 已知2A(g)+B(g)?n C(g),在密闭容器中进行,K(300℃)>K(350℃),某温度下,A的平衡转化率(a)与体系总压强(P)的关系如图所示.下列说法正确的是( )
已知2A(g)+B(g)?n C(g),在密闭容器中进行,K(300℃)>K(350℃),某温度下,A的平衡转化率(a)与体系总压强(P)的关系如图所示.下列说法正确的是( )
 已知2A(g)+B(g)?n C(g),在密闭容器中进行,K(300℃)>K(350℃),某温度下,A的平衡转化率(a)与体系总压强(P)的关系如图所示.下列说法正确的是( )
已知2A(g)+B(g)?n C(g),在密闭容器中进行,K(300℃)>K(350℃),某温度下,A的平衡转化率(a)与体系总压强(P)的关系如图所示.下列说法正确的是( )| A. | 该反应正反应是吸热反应 | |
| B. | 反应温度升高,A的转化率增大 | |
| C. | 平衡状态由a变到b时,化学平衡常数K(A)小于K(B) | |
| D. | 容器内气体的平均相对分子质量不变,说明反应达到化学平衡状态 |
 +O2$→_{△}^{Cu}$OHC-CHO+2H2O.
+O2$→_{△}^{Cu}$OHC-CHO+2H2O.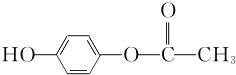 .
. .
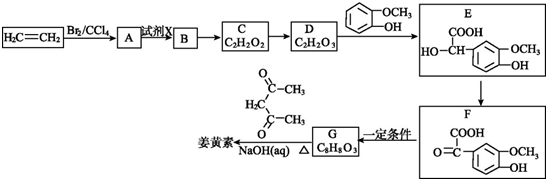
. 有A、B、C、D、E、F六种短周期元素,其元素特征信息如下:
有A、B、C、D、E、F六种短周期元素,其元素特征信息如下: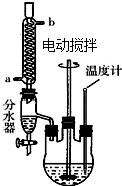 草酸二乙酯可用于苯巴比妥等药物的中间体,实验室以草酸(HOOC-COOH)和乙醇为原料制备草酸二乙酯的实验步骤如下:
草酸二乙酯可用于苯巴比妥等药物的中间体,实验室以草酸(HOOC-COOH)和乙醇为原料制备草酸二乙酯的实验步骤如下: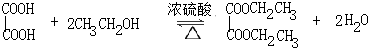 ,
, .
.