题目内容
在一固定容积为2L的密闭容器内加入0.2mol的N2和0.6mol的H2,在一定条件下发生如下反应:
N2(g)+3H2(g)?2NH3(g)+Q(Q>0),
(1)该反应所用的催化剂是 (填写名称)
该反应450℃的平衡常数 500℃时的平衡常数(填“>”、“<”或“=”).
(2)下列描述中能说明上述反应已达平衡的是
A.3V正(H2)=2V逆(NH3) B.容器中气体的平均分子量不随时间而变化
C.容器中气体的密度不随时间而变化 D.容器中气体的分子总数不随时间而变化
(3)如上述反应若第5分钟时达到平衡,测得NH3的物质的量为0.2mol计算从反应开始到平衡时,平均反应速率v(N2)为 mol/(L.min).
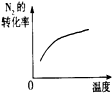
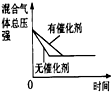
(4)下列研究目的和示意图相符的是 .
N2(g)+3H2(g)?2NH3(g)+Q(Q>0),
(1)该反应所用的催化剂是
该反应450℃的平衡常数
(2)下列描述中能说明上述反应已达平衡的是
A.3V正(H2)=2V逆(NH3) B.容器中气体的平均分子量不随时间而变化
C.容器中气体的密度不随时间而变化 D.容器中气体的分子总数不随时间而变化
(3)如上述反应若第5分钟时达到平衡,测得NH3的物质的量为0.2mol计算从反应开始到平衡时,平均反应速率v(N2)为
(4)下列研究目的和示意图相符的是
| A | B | C | D | |
| 研究目的 | 压强对反应的影响(P1>P2) | 温度对反应的影响 | 平衡体系增加N2对反应的影响 | 催化剂对反应的影响 |
| 图示 |  |
 |
 |
 |
考点:化学平衡的影响因素,化学平衡状态的判断
专题:化学平衡专题
分析:(1)工业合成氨的催化剂是以铁为载体的催化剂为铁触媒,反应是放热反应,温度升高,平衡逆向进行,平衡常数减小;
(2)反应达到平衡状态时,正逆反应速率相等,平衡时各种物质的物质的量、浓度等不再发生变化,可由此进行判断;
(3)依据反应速率概念计算氨气的反应速率,结合速率之比等于化学方程式系数之比换算得到氮气的反应速率;
(4)A、合成氨反应是气体体积缩小的反应,则利用压强对化学平衡及化学反应速率的影响,然后结合图象来分析;
B、合成氨的反应是放热反应,利用温度对化学平衡的影响及图象来分析;
C、利用增大反应物的浓度对化学平衡移动的影响并结合图象来分析;
D、利用催化剂对化学反应速率及化学平衡的影响,结合图象来分析.
(2)反应达到平衡状态时,正逆反应速率相等,平衡时各种物质的物质的量、浓度等不再发生变化,可由此进行判断;
(3)依据反应速率概念计算氨气的反应速率,结合速率之比等于化学方程式系数之比换算得到氮气的反应速率;
(4)A、合成氨反应是气体体积缩小的反应,则利用压强对化学平衡及化学反应速率的影响,然后结合图象来分析;
B、合成氨的反应是放热反应,利用温度对化学平衡的影响及图象来分析;
C、利用增大反应物的浓度对化学平衡移动的影响并结合图象来分析;
D、利用催化剂对化学反应速率及化学平衡的影响,结合图象来分析.
解答:
解:(1)工业合成氨的催化剂是以铁为载体的催化剂为铁触媒,反应是放热反应,温度升高,平衡逆向进行,平衡常数减小,反应450℃的平衡常数大于500℃时的平衡常数,
故答案为:铁触媒;>;
(2)A.化学反应速率之比等于系数之比,当2v正(H2)=3v逆(NH3)才证明平衡,故A错误;
B.容器中气体的平均相对分子量M=
,n对于该反应来说是变化的,当n不变化了,即M不变化了,达到平衡,故B正确;
C.容器中气体的密度ρ=
,密度始终是不随时间而变化的一个定值,故C错误;
D.容器中气体的分子总数不随时间而变化证明各组分浓度保持不变了,故D正确;
故答案为:BD;
(3)如上述反应若第5分钟时达到平衡,测得NH3的物质的量为0.2mol计算从反应开始到平衡时,氨气的反应速V(HN3)=)=
=0.02mol/L?min,反应速率之比等于化学方程式系数之比,平均反应速率v(N2)=
V(HN3)=0.01mol/(L?min),
故答案为:0.01;
(4)A、该反应中增大压强平衡向正反应方向移动,则氨气的体积分数增大,并且压强越大,化学反应速率越大,达到化学平衡的时间越少,与图象不符,故A错误;
B、因该反应是放热反应,升高温度化学平衡向逆反应反应移动,则氮气的转化率降低,与图象中转化率增大不符,故B错误;
C、反应平衡后,增大氮气的量,则这一瞬间正反应速率增大,逆反应速率不变,然后正反应速率在不断减小,逆反应速率不断增大,直到新的平衡,与图象符合,故C正确;
D、因催化剂对化学平衡无影响,但催化剂加快化学反应速率,则有催化剂时达到化学平衡的时间少,与图象不符,故D错误;
故答案为:C.
故答案为:铁触媒;>;
(2)A.化学反应速率之比等于系数之比,当2v正(H2)=3v逆(NH3)才证明平衡,故A错误;
B.容器中气体的平均相对分子量M=
| m |
| n |
C.容器中气体的密度ρ=
| m |
| V |
D.容器中气体的分子总数不随时间而变化证明各组分浓度保持不变了,故D正确;
故答案为:BD;
(3)如上述反应若第5分钟时达到平衡,测得NH3的物质的量为0.2mol计算从反应开始到平衡时,氨气的反应速V(HN3)=)=
| ||
| 5min |
| 1 |
| 2 |
故答案为:0.01;
(4)A、该反应中增大压强平衡向正反应方向移动,则氨气的体积分数增大,并且压强越大,化学反应速率越大,达到化学平衡的时间越少,与图象不符,故A错误;
B、因该反应是放热反应,升高温度化学平衡向逆反应反应移动,则氮气的转化率降低,与图象中转化率增大不符,故B错误;
C、反应平衡后,增大氮气的量,则这一瞬间正反应速率增大,逆反应速率不变,然后正反应速率在不断减小,逆反应速率不断增大,直到新的平衡,与图象符合,故C正确;
D、因催化剂对化学平衡无影响,但催化剂加快化学反应速率,则有催化剂时达到化学平衡的时间少,与图象不符,故D错误;
故答案为:C.
点评:本题考查化学平衡标志的分析判断,化学反应速率概念分析应用,明确影响化学反应速率及化学平衡的影响因素,图象中纵横坐标的含义即可解答,题目难度中等.

练习册系列答案
相关题目
下列离子方程式书写正确的是( )
| A、向次氯酸钠溶液中通入少量二氧化硫:2ClO-+SO2+H2O=SO32-+2HClO |
| B、用食醋除去水瓶中的水垢:CO32-+2CH3COOH=2CH3COO-+CO2↑+H2O |
| C、碳酸氢铵溶液与少量氢氧化钠溶液反应NH4++OH-═NH3?H2O |
| D、向明矾溶液中加入过量的氢氧化钡溶液:Al3++2SO42-+2Ba2++4OH-=2BaSO4↓+AlO2-+2H2O |
汽车尾气中含有一氧化氮和一氧化碳,消除这两种物质产生的大气污染的方法是安装催化转换器,使它们发生反应生成CO2和N2.反应方程式为:2CO+2NO
2CO2+N2,其中NO是( )
| ||
| △ |
| A、氧化剂 |
| B、还原剂 |
| C、既是氧化剂又是还原剂 |
| D、既不是氧化剂又不是还原剂 |
蒙古牧民喜欢用银器盛放鲜牛奶.现代科学证明,用银器盛放牛奶,确有其科学道理,因为( )
| A、溶入极微量的银离子,可以杀死牛奶中的细菌,防止牛奶变质 |
| B、用银器盛放牛奶,可以补充人体所需的银元素 |
| C、银易导热,牛奶凉得快 |
| D、银的化学性质稳定,坚固耐用 |

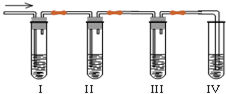 化学课外兴趣小组学生在实验室里制取的乙烯中常混有少量的二氧化硫,老师启发他们并由他们自己设计了如图实验图以确认上述混合气体中有乙烯和二氧化硫.回答下列问题:
化学课外兴趣小组学生在实验室里制取的乙烯中常混有少量的二氧化硫,老师启发他们并由他们自己设计了如图实验图以确认上述混合气体中有乙烯和二氧化硫.回答下列问题: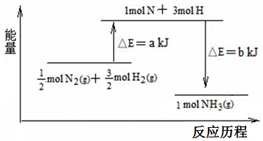 在化学反应中,反应物转化成生成物,必然发生能量的变化.
在化学反应中,反应物转化成生成物,必然发生能量的变化.