题目内容
12.下列实验能达到实验目的是( )| A. |  制取金属锰 | |
| B. |  制取二氧化碳 | |
| C. |  蒸发饱和食盐水制取食盐晶体 | |
| D. |  验证FeCl3对H2O2分解反应有催化作用 |
分析 A.点燃Mg条,引发铝热反应,可冶炼熔点高的金属;
B.硫酸与碳酸钙反应生成微溶的硫酸钙,易堵塞多孔塑料片;
C.蒸发应在蒸发皿中进行;
D.温度、催化剂两个变量.
解答 解:A.点燃Mg条,引发铝热反应,可冶炼熔点高的金属,则图中装置可冶炼Mn,故A正确;
B.硫酸与碳酸钙反应生成微溶的硫酸钙,易堵塞多孔塑料片,应选稀盐酸与碳酸钙反应制备,故B错误;
C.蒸发应在蒸发皿中进行,不能选坩埚,故C错误;
D.温度、催化剂两个变量,应控制温度相同时,只有催化剂一个变量验证FeCl3对H2O2分解反应有催化作用,故D错误;
故选A.
点评 本题考查化学实验方案的评价,为高频考点,把握实验装置的作用、铝热反应、气体的制备、混合物分离提纯、影响反应速率的因素为解答的关键,侧重分析与实验能力的考查,注意实验的评价性分析,题目难度不大.

练习册系列答案
 应用题作业本系列答案
应用题作业本系列答案
相关题目
2.将15%的NaOH溶液蒸发掉100g水后得到质量分数为30%体积为95mL的NaOH溶液,则此时溶液的物质的量浓度为( )
| A. | 7.9mol/L | B. | 6.25mol/L | C. | 6.75 mol/L | D. | 7 mol/L |
3.下列电离方程式或水解方程式正确的是( )
| A. | H2S?2H++S2- | B. | NaHSO4═Na++H++SO42- | ||
| C. | CO32-+2H2O?H2CO3+2OH- | D. | Al3++3H2O?Al(OH)3↓+3H+ |
20.我国科学家前不久成功合成3nm长的管状碳纳米管,长度居世界之首.这种碳纤维具有强度高、刚度(抵抗变形的能力)高、密度小(只有钢的$\frac{1}{4}$)、熔点高,化学稳定性好的特点,固此被称为“超级纤维”.下列对碳纤维的说法中不正确的是( )
| A. | 它是制造飞机的理想材料 | B. | 它的主要组成元素是碳元素 | ||
| C. | 它的结构与石墨相似 | D. | 碳纤维复合材料不易导电 |
7.氯碱工业是一种高能耗产业,下图表示的是电解池与燃料电池相组合的一种节能新工艺.图中电极末画出,只显示了相关物料的传输和转化关系.下列有关该工艺流程的分析正确的是( )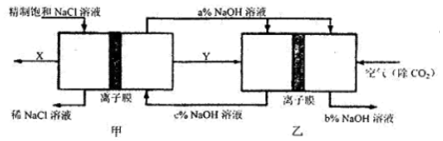

| A. | 甲装置为电解池,其左室为阴极室 | |
| B. | 甲乙两装置中使用的均为阳离子交换膜 | |
| C. | 乙装置为燃料电池,其左室反应为H2-2e-═2H+ | |
| D. | 图中三种NaOH溶液的质量分数关系为b%>c%>a% |
5.运用化学反应原理研究NH3的性质具有重要意义.请回答下列问题:
(1)氨气可以构成燃料电池,其电池反应原理为4NH3+3O2═2N2+6H2O.NH3应通入燃料电池的负极(填“正极”或“负极”).已知电解质溶液为KOH溶液,正极的电极反应式为O2+2H2O+4e-=4OH-.
(2)25℃时,将a mol•L-1的氨水与0.1mol•L-1的盐酸等体积混合.
①当溶液中离子浓度关系满足c(NH4+)>c(Cl-)时,则反应的情况可能为a.
a.盐酸不足,氨水剩余 b.氨水与盐酸恰好完全反应 c.盐酸过量
②当溶液中c(NH4+)=c(Cl-)时,用含a的代数式表示NH3•H2O的电离常数Ka=$\frac{1{0}^{-8}}{a-0.1}$.
(3)在0.5L恒容密闭容器中,一定量的N2与H2进行反应:N2(g)+3H2(g)?2NH3(g)△H=bkJ•mol-1,其化学平衡常数K与温度的关系如下:
①写出该反应的化学平衡常数的表达式:K=$\frac{{c}^{2}(N{H}_{3})}{c({N}_{2})•{c}^{3}({H}_{2})}$,b小于(填“大于”“小于”或“等于”)0.
②400℃时,测得某时刻氨气、氮气、氢气的物质的量分别为3mol、2mol、1mol时,此时刻该反应的v正(N2)小于(填“大于”“小于”或“等于”)v逆(N2).
(4)已知:
①4NH3(g)+3O2(g)═2N2(g)+6H2O(g)△H=-1266.8kJ•mol-1
②N2(g)+O2(g)═2NO(g)△H=+180.5kJ•mol-1
写出氨高温催化氧化的热化学方程式4NH3(g)+5O2(g)=4NO(g)+6H2O(g)△H=-905.8kJ/mol.
(1)氨气可以构成燃料电池,其电池反应原理为4NH3+3O2═2N2+6H2O.NH3应通入燃料电池的负极(填“正极”或“负极”).已知电解质溶液为KOH溶液,正极的电极反应式为O2+2H2O+4e-=4OH-.
(2)25℃时,将a mol•L-1的氨水与0.1mol•L-1的盐酸等体积混合.
①当溶液中离子浓度关系满足c(NH4+)>c(Cl-)时,则反应的情况可能为a.
a.盐酸不足,氨水剩余 b.氨水与盐酸恰好完全反应 c.盐酸过量
②当溶液中c(NH4+)=c(Cl-)时,用含a的代数式表示NH3•H2O的电离常数Ka=$\frac{1{0}^{-8}}{a-0.1}$.
(3)在0.5L恒容密闭容器中,一定量的N2与H2进行反应:N2(g)+3H2(g)?2NH3(g)△H=bkJ•mol-1,其化学平衡常数K与温度的关系如下:
| 温度/℃ | 200 | 300 | 400 |
| K | 1.0 | 0.85 | 0.5 |
②400℃时,测得某时刻氨气、氮气、氢气的物质的量分别为3mol、2mol、1mol时,此时刻该反应的v正(N2)小于(填“大于”“小于”或“等于”)v逆(N2).
(4)已知:
①4NH3(g)+3O2(g)═2N2(g)+6H2O(g)△H=-1266.8kJ•mol-1
②N2(g)+O2(g)═2NO(g)△H=+180.5kJ•mol-1
写出氨高温催化氧化的热化学方程式4NH3(g)+5O2(g)=4NO(g)+6H2O(g)△H=-905.8kJ/mol.
9.某学习小组,用稀HNO3与大理石反应过程中质量减小的方法,探究影响反应速率的因素.所用HNO3浓度为1.00mol•L-1、2.00mol•L-1,大理石有细颗粒与粗颗粒两种规格,实验温度为298K、308K,每次实验HNO3的用量为25.00mL、大理石用量为10.00g.
实验设计如表:
将相应的实验目的填入下列空格中:
(1)实验①和②探究浓度对该反应速率的影响;
(2)实验①和③探究温度对该反应速率的影响;
(3)实验①和④探究固体颗粒大小对该反应速率的影响.
实验设计如表:
| 编号 | T/K | 大理石规格 | HNO3浓度 |
| ① | 298 | 粗颗粒 | 2.00 mol•L-1 |
| ② | 298 | 粗颗粒 | 1.00 mol•L-1 |
| ③ | 308 | 粗颗粒 | 2.00 mol•L-1 |
| ④ | 298 | 细颗粒 | 2.00 mol•L-1 |
(1)实验①和②探究浓度对该反应速率的影响;
(2)实验①和③探究温度对该反应速率的影响;
(3)实验①和④探究固体颗粒大小对该反应速率的影响.
10.用沉淀法测定KHCO3和Na2CO3固体混合物的组成,每次称取一定质量的样品溶于水制成洛液,向其中滴加相同浓度的Ba(OH)2溶液,每次实验均充分反应,反应前后溶液体积变化忽略不计,实验记录见表:
回答下列问题:
(1)样品中KHCO3和Na2CO3的物质的量之比2:1.
(2)室温下第Ⅲ组实验所得溶液中的OH-物质的量浓度为0.2mol/L.
| 实验序号 | Ⅰ | Ⅱ | Ⅲ | Ⅳ | Ⅴ |
| 样本质量(g) | 3.06 | 6.12 | 9.18 | 12.24 | 15.30 |
| Ba(OH)2溶液体积(mL) | 300 | 300 | 300 | 300 | 300 |
| 生成沉淀的质量(g) | 5.19 | 11.82 | 17.73 | 23.64 | 23.64 |
(1)样品中KHCO3和Na2CO3的物质的量之比2:1.
(2)室温下第Ⅲ组实验所得溶液中的OH-物质的量浓度为0.2mol/L.