题目内容
9.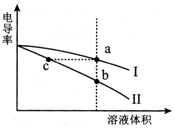 电导率是衡量电解质溶液导电能力大小的物理量.常温下,将相同体积的氢氧化钠溶液和醋酸溶液分别加水稀释,溶液的电导率随溶液体积变化的曲线如图所示.下列说法正确的是( )
电导率是衡量电解质溶液导电能力大小的物理量.常温下,将相同体积的氢氧化钠溶液和醋酸溶液分别加水稀释,溶液的电导率随溶液体积变化的曲线如图所示.下列说法正确的是( )| A. | I表示NaOH溶液加水稀释过程中溶液电导率的变化 | |
| B. | a、b、c三点溶液的pH:b>c>a | |
| C. | 将a、b两点溶液混合,所得溶液中:c(Na+)>c(CH3COO-)>c(OH-)>c(H+) | |
| D. | a点水电离出的n(H+)等于c点水电离出的n(H+) |
分析 稀释之前,两种溶液导电能力相等,说明离子浓度相等,由于醋酸为弱电解质,不能完全电离,则醋酸浓度大于氢氧化钠浓度,加水稀释时,醋酸进一步电离,Ⅰ为醋酸稀释曲线,Ⅱ为氢氧化钠稀释曲线,据此分析.
解答 解:A.加水稀释时,醋酸进一步电离,导电能力变化较小,则Ⅰ为醋酸稀释曲线,故A错误;
B.NaOH溶液显碱性,醋酸显酸性,导电能力越大,说明离子浓度越大,则a、b、c三点溶液的pH:c>b>a,故B错误;
C.将a、b两点溶液混合,由于醋酸浓度大于氢氧化钠浓度,反应后醋酸过量,溶液显酸性,则溶液中:c(CH3COO-)>c(Na+)>c(H+)>c(OH-),故C错误;
D.a点的导电率与b点相同,则a点离子浓度等于c点离子浓度,对水的电离抑制程度相同,则a点水电离出的n(H+)等于c点水电离出的n(H+),故D正确.
故选D.
点评 本题考查弱电解质的电离,题目难度中等,注意溶液离子浓度与导电性之间的关系,侧重于考查学生的分析能力和对基本原理的应用能力.

练习册系列答案
相关题目
19.某晶体化学式为N2H6SO4,其晶体类型与硫酸铵相同.试分析在该晶体中不会存在( )
| A. | 阳离子 | B. | 共价键 | C. | 离子键 | D. | 分子间作用力 |
17.设NA为阿伏加德罗常数的值,下列说法正确的是( )
| A. | 常温常压下,14g由N2与CO组成的混合气体含有的原子数目为NA | |
| B. | 常温常压下,1molNO2气体与水完全反应,转移电子数为NA | |
| C. | 标准状况下,11.2LC2H5OH中所含的分子数为0.5NA | |
| D. | 常温常压下,17gNH3中含有的共用电子对数为4NA |
4.下列离子方程式书写正确的是( )
| A. | 硫酸铜溶液吸收H2S:Cu2++S2-═CuS↓ | |
| B. | 磁性氧化铁溶于氢碘酸:Fe3O4+8H+═Fe2++2Fe3++4H2O | |
| C. | 向饱和碳酸钠溶液中通入足量CO2:CO32-+CO2+H2O═2HCO3- | |
| D. | 向KAl(SO4)2溶液中加入过量的Ba(OH)2溶液:Al3++2SO42-+2Ba2++4OH-═2BaSO4↓+AlO2-+2H2O |
3.某同学采用硫铁矿焙烧取硫后的烧渣(主要成分为Fe2O3、SiO2、Al2O3,不考虑其他杂质)制取七水合硫酸亚铁(FeSO4•7H2O),设计了如图流程:下列说法不正确的是( )
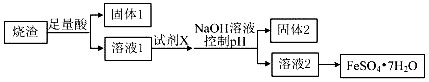

| A. | 溶解烧渣选用足量硫酸,试剂X选用铁粉 | |
| B. | 固体1中一定含有SiO2,控制pH是为了使Al3+转化为Al(OH)3,进入固体2 | |
| C. | 从溶液2得到FeSO4•7H2O产品的过程中,须控制条件防止其氧化和分解 | |
| D. | 若改变方案,在溶液1中直接加NaOH至过量,得到的沉淀用硫酸溶解,其溶液经结晶分离也可得到FeSO4•7H2O |
10.化学与生产、生活密切相关,下列事实的解释正确的是 ( )
| 选项 | 事实 | 解释 |
| A | 酸雨的pH<5.6 | CO2溶解在雨水中 |
| B | 稻草、甘蔗渣可用来造纸 | 稻草、甘蔗渣富含纤维素 |
| C | 化石燃料燃烧时采取固硫措施 | 提高化石燃料的利用率 |
| D | 将水中的铁闸门连接电源的负极而防腐 | 利用牺牲阳极的阴极保护法 |
| A. | A | B. | B | C. | C | D. | D |
7.下列有关Cl、N、S等非金属元素化合物的说法正确的是( )
| A. | 漂白粉是纯净物,其成分就是次氯酸钙 | |
| B. | 实验室可用浓硫酸干燥氨气 | |
| C. | 实验室可用NaOH溶液处理SO2和HCl废气 | |
| D. | 浓盐酸、浓硫酸、浓硝酸都有强氧化性,能氧化金属铜 |
8.砹是核电荷数最大的卤族元素,推断砹及砹的化合物不可能具有的性质是( )
①HAt很稳定
②砹易溶于某些有机溶剂
③砹的熔沸点较高
④砹是有色固体
⑤砹化银不溶于水
⑥砹在水中溶解度较小.
①HAt很稳定
②砹易溶于某些有机溶剂
③砹的熔沸点较高
④砹是有色固体
⑤砹化银不溶于水
⑥砹在水中溶解度较小.
| A. | 只有① | B. | 只有①② | C. | 只有③④⑤ | D. | 只有②④⑤ |
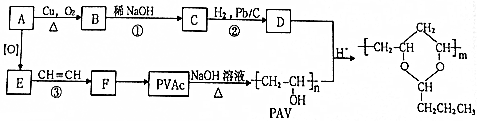

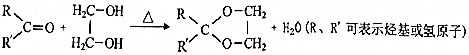
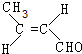 ,该分子中最多有9个原子共平面;
,该分子中最多有9个原子共平面; $→_{△}^{NaOH}$
$→_{△}^{NaOH}$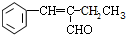 +H2O;
+H2O;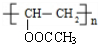 ;
;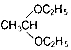 .
.