题目内容
3.某同学采用硫铁矿焙烧取硫后的烧渣(主要成分为Fe2O3、SiO2、Al2O3,不考虑其他杂质)制取七水合硫酸亚铁(FeSO4•7H2O),设计了如图流程:下列说法不正确的是( )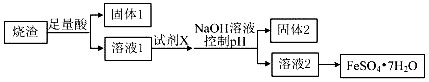
| A. | 溶解烧渣选用足量硫酸,试剂X选用铁粉 | |
| B. | 固体1中一定含有SiO2,控制pH是为了使Al3+转化为Al(OH)3,进入固体2 | |
| C. | 从溶液2得到FeSO4•7H2O产品的过程中,须控制条件防止其氧化和分解 | |
| D. | 若改变方案,在溶液1中直接加NaOH至过量,得到的沉淀用硫酸溶解,其溶液经结晶分离也可得到FeSO4•7H2O |
分析 硫铁矿焙烧取硫后的烧渣(主要成分为Fe2O3、SiO2、Al2O3,不考虑其它杂质),混合物中加入足量硫酸,Fe2O3、Al2O3与酸反应生成的硫酸铁、硫酸铝,二氧化硅不反应,过滤,固体1为二氧化硅;在滤液中加入铁粉将铁离子还原为亚铁离子,调节pH值使铝离子完全生成氢氧化铝沉淀,过滤,固体2为氢氧化铝,溶液2为硫酸亚铁,蒸发浓缩、冷却结晶、过滤,得到硫酸亚铁晶体,以此来解答.
解答 解:硫铁矿焙烧取硫后的烧渣(主要成分为Fe2O3、SiO2、Al2O3,不考虑其他杂质),混合物中加入足量硫酸,Fe2O3、Al2O3与酸反应生成的硫酸铁、硫酸铝,二氧化硅不反应,过滤,固体1为二氧化硅;在滤液中加入铁粉将铁离子还原为亚铁离子,调节pH值使铝离子完全生成氢氧化铝沉淀,过滤,固体2为氢氧化铝,溶液2为硫酸亚铁,蒸发浓缩、冷却结晶、过滤,得到硫酸亚铁晶体,
A.由流程分析可知,溶解烧渣选用足量硫酸,X为铁粉,故A正确;
B.由流程分析可知,固体1中一定含有SiO2,调节pH值使铝离子完全生成氢氧化铝沉淀,则固体2为氢氧化铝,故B正确;
C.亚铁离子易被空气中的氧气氧化,而且受热易失去结晶水,所以从溶液2得到FeSO4•7H2O产品的过程中,须控制条件防止其氧化和分解,故C正确;
D.在溶液1中含有铁离子和铝离子,加过量的氢氧化钠,铝离子转化为偏铝酸根离子,铁离子与氢氧根离子结合生成氢氧化铁沉淀,所以最终得到的是硫酸铁而不是硫酸亚铁,故D错误;
故选D.
点评 本题考查制备实验方案及混合分离提纯,为高考常见题型,把握流程中的反应、分离方法为解答的关键,侧重学生分析能力和创新能力的培养,注意把握常见物质的分离方法,题目难度中等.

练习册系列答案
 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案 口算与应用题卡系列答案
口算与应用题卡系列答案 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案
相关题目
4.下列各组反应中,反应物的相对用量对产物组成无影响的是( )
| A. | 铁与稀硝酸 | B. | 硫化氢与氧气 | ||
| C. | 1,3-丁二烯与溴 | D. | 过氧化钠与二氧化碳 |
2.实验室制备硝基苯时,经过配制混酸、硝化反应(50~60℃)、洗涤分液、干燥蒸馏等步骤,下列图示装置和原理能达到实验目的是( )
| A. | 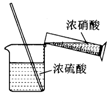 配制混酸 | B. | 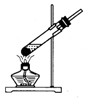 硝化反应 | C. |  分离硝基苯 | D. | 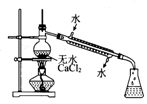 蒸馏硝基苯 |
9.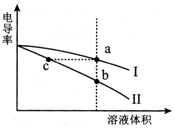 电导率是衡量电解质溶液导电能力大小的物理量.常温下,将相同体积的氢氧化钠溶液和醋酸溶液分别加水稀释,溶液的电导率随溶液体积变化的曲线如图所示.下列说法正确的是( )
电导率是衡量电解质溶液导电能力大小的物理量.常温下,将相同体积的氢氧化钠溶液和醋酸溶液分别加水稀释,溶液的电导率随溶液体积变化的曲线如图所示.下列说法正确的是( )
 电导率是衡量电解质溶液导电能力大小的物理量.常温下,将相同体积的氢氧化钠溶液和醋酸溶液分别加水稀释,溶液的电导率随溶液体积变化的曲线如图所示.下列说法正确的是( )
电导率是衡量电解质溶液导电能力大小的物理量.常温下,将相同体积的氢氧化钠溶液和醋酸溶液分别加水稀释,溶液的电导率随溶液体积变化的曲线如图所示.下列说法正确的是( )| A. | I表示NaOH溶液加水稀释过程中溶液电导率的变化 | |
| B. | a、b、c三点溶液的pH:b>c>a | |
| C. | 将a、b两点溶液混合,所得溶液中:c(Na+)>c(CH3COO-)>c(OH-)>c(H+) | |
| D. | a点水电离出的n(H+)等于c点水电离出的n(H+) |
8.下列热化学方程式中,正确的是( )
| A. | 甲烷的燃烧热△H=-890.3 kJ•mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-890.3 kJ•mol-1 | |
| B. | 在25℃、101 kPa时,2gH2完全燃烧生成液态水,放出285.8 kJ热量,氢气燃烧的热化学方程式表示为2H2(g)+O2(g)═2H2O(l)△H=-571.6 kJ•mol-1 | |
| C. | 一定条件下,将0.5 mol N2和1.5 mol H2置于密闭容器中充分反应生成NH3放热19.3kJ,其热化学方程式为:N2(g)+3H2(g)?2NH3(g)△H=-38.6 kJ•mol-1 | |
| D. | HCl和NaOH反应的中和热△H=-57.3 kJ•mol-1,则H2SO4和Ca(OH)2反应的中和热为△H=2×(-57.3)kJ•mol-1 |
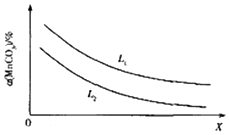 MnO2是常见的氧化剂、催化剂和活性电极材料.
MnO2是常见的氧化剂、催化剂和活性电极材料. 实验室制取氨气有几种方法.
实验室制取氨气有几种方法.