题目内容
7.下列各项中表达正确的是( )| A. | H、D、T表示同一种核素 | B. | F的结构示意图: | ||
| C. | Na2O的电子式: | D. | MgCl2的形成过程: |
分析 A.H、D、T的质子数相同、中子数不同,为同种元素的不同原子;
B.F原子的最外层电子数为7;
C.氧化钠为离子化合物,钠离子不能合并;
D.氯化镁为离子化合物.
解答 解:A.H、D、T的质子数相同、中子数不同,为同种元素的不同原子,为不同核素,互为同位素,故A错误;
B.F原子的最外层电子数为7,F的结构示意图为 ,故B错误;
,故B错误;
C.氧化钠为离子化合物,钠离子不能合并,Na2O的电子式为 ,故C错误;
,故C错误;
D.氯化镁为离子化合物,电子式表示形成过程为 故D正确;
故D正确;
故选D.
点评 本题综合考查化学用语,为高频考点,把握电子式、结构示意图为解答的关键,侧重分析与应用能力的考查,注意化学用语的区别及规范使用,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
17.不符合工业治炼金属情况的是( )
| A. | 2HgO$\frac{\underline{\;\;△\;\;}}{\;}$2Hg+O2↑ | B. | Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2 | ||
| C. | 2MgO$\frac{\underline{\;\;△\;\;}}{\;}$2Mg+O2↑ | D. | MgCl2$\frac{\underline{\;电解\;}}{熔融}$Mg+Cl2↑ |
15.下列事实不能用电化学理论解释的是( )
| A. | 纯铁制品比钢铁制品更耐腐蚀 | |
| B. | 同种金属作为原电池的正极比作为电解池的阳极腐蚀得更慢 | |
| C. | 钢管镀锌时,锌棒做阳极,钢管做阴极,锌盐溶液做电解质溶液 | |
| D. | 铝片不用特殊方法保存 |
2.下列实验中,所采取的分离方法与对应原理都正确的是( )
| 选项 | 目的 | 分离方法 | 原理 |
| A | 分离溶于水的碘 | 苯萃取 | 苯的密度比水小 |
| B | 分离乙酸乙酯和乙醇 | 分液 | 乙酸乙酯和乙醇的密度不同 |
| C | 除去KNO3固体中混杂的NaCl | 重结晶 | KNO3在水中的溶解度很大 |
| D | 除去纯碱中的碳酸氢铵 | 加热 | 热稳定不同 |
| A. | A | B. | B | C. | C | D. | D |
12.下列有关说法正确的是( )
| A. | 活化分子之间发生的碰撞一定为有效碰撞 | |
| B. | 升高温度,降低反应的活化能,可使活化分子的百分数增大,因而反应速率增大 | |
| C. | 金属腐蚀就是金属失去电子被氧化的过程 | |
| D. | 电解法精炼铜时,以粗铜作阳极,粗铜中的所有金属都以离子的形式进入电解质溶液 |
19.下列顺序不正确的是( )
| A. | 失电子能力:Na<K | B. | 碱性:NaOH<KOH | ||
| C. | 得电子能力:S<Cl | D. | 酸性:HClO4<H2SO4 |
16.对于化学平衡与化学反应速率关系的叙述正确的是( )
| A. | 化学反应速率变化时,化学平衡一定发生移动 | |
| B. | 化学平衡发生移动时,化学反应速率一定变化 | |
| C. | 正反应进行的程度大,正反应速率一定大 | |
| D. | 化学反应速率变化而化学平衡不移动的情况,只有使用催化剂条件下才会发生 |
19.以下物质中一定属于纯净物的是( )
①铝热剂 ②液氯 ③普通玻璃 ④漂白粉 ⑤CuSO4•5H2O ⑥医用酒精 ⑦分子式为C7H8的芳香烃 ⑧H2SO4.
①铝热剂 ②液氯 ③普通玻璃 ④漂白粉 ⑤CuSO4•5H2O ⑥医用酒精 ⑦分子式为C7H8的芳香烃 ⑧H2SO4.
| A. | ①②④⑤ | B. | ②⑤⑦⑧ | C. | ③④⑥⑦ | D. | ②③④⑤ |
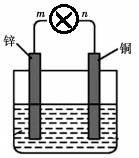 将质量均为100g的锌片和铜片用导线与灯泡串联浸入盛有500mL 2mol•L-1稀硫酸溶液的1.5L容器中构成如图装置.
将质量均为100g的锌片和铜片用导线与灯泡串联浸入盛有500mL 2mol•L-1稀硫酸溶液的1.5L容器中构成如图装置.