题目内容
15.下列事实不能用电化学理论解释的是( )| A. | 纯铁制品比钢铁制品更耐腐蚀 | |
| B. | 同种金属作为原电池的正极比作为电解池的阳极腐蚀得更慢 | |
| C. | 钢管镀锌时,锌棒做阳极,钢管做阴极,锌盐溶液做电解质溶液 | |
| D. | 铝片不用特殊方法保存 |
分析 不能用电化学原理解释说明该装置不能构成原电池,只能发生化学腐蚀,根据原电池的构成条件来分析解答,原电池的构成条件是:原电池的构成条件是:①有两个活泼性不同的电极,②将电极插入电解质溶液中,③两电极间构成闭合回路,④能自发的进行氧化还原反应,作原电池负极的金属加速被腐蚀,作原电池正极的金属被保护.
解答 解:A.纯铁结构则不能形成原电池反应,钢中则含杂质碳,在电解质水膜中形成原电池反应,反应加快,纯铁制品比钢铁制品更耐腐蚀,能用电化学理论解释,故A不选;
B.一般金属腐蚀速率为:电解池的阳极>原电池的负极>化学腐蚀>原电池的正极>电解池的阴极,同种金属作为原电池的正极比作为电解池的阳极腐蚀得更慢,能用电化学理论解释,故B不选;
C.电镀是镀层金属做阳极,待镀金属作阴极,含镀层金属离子的盐溶液为电解质溶液,钢管镀锌时,锌棒做阳极,钢管做阴极,锌盐溶液做电解质溶液发生电解反应,能用电化学理论解释,故C不选;
D.铝片因在空气中被O2氧化,使铝片表面形成一层致密的氧化物薄膜而保护内层的铝不再被氧化,所以铝片不用特殊方法保存,此现象与电化学知识无关,故D选;
故选D.
点评 本题考查了金属的腐蚀与防护,明确电化学腐蚀与化学腐蚀的区别是解本题关键,再结合原电池构成条件来分析解答,题目难度不大

练习册系列答案
 期末宝典单元检测分类复习卷系列答案
期末宝典单元检测分类复习卷系列答案
相关题目
5.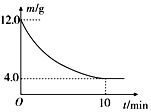 在一定的条件下,向2L密闭容器中进行一定量MgSO4和CO的反应:MgSO4(s)+CO(g)?MgO(s)+CO2(g)+SO2(g).反应时间与残留固体的质量关系如图所示. 下列说法正确的是( )
在一定的条件下,向2L密闭容器中进行一定量MgSO4和CO的反应:MgSO4(s)+CO(g)?MgO(s)+CO2(g)+SO2(g).反应时间与残留固体的质量关系如图所示. 下列说法正确的是( )
 在一定的条件下,向2L密闭容器中进行一定量MgSO4和CO的反应:MgSO4(s)+CO(g)?MgO(s)+CO2(g)+SO2(g).反应时间与残留固体的质量关系如图所示. 下列说法正确的是( )
在一定的条件下,向2L密闭容器中进行一定量MgSO4和CO的反应:MgSO4(s)+CO(g)?MgO(s)+CO2(g)+SO2(g).反应时间与残留固体的质量关系如图所示. 下列说法正确的是( )| A. | 升高温度时,正反应速率增大,逆反应速率减小 | |
| B. | 随着反应的进行,混合气体的平均相对分子质量增大 | |
| C. | 增加硫酸镁的质量时,正反应速率将增大 | |
| D. | 在 0~10min内,v(CO)=0.01mol?L-1?min-1 |
6.下列物质中,能使FeCl3溶液呈紫色的是( )
| A. | CH3CH2OH | B. |  | C. |  | D. |  |
20.常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A. | 1.0mol•L-lKNO3溶液:H+、Fe2+、Cl-、SO42- | |
| B. | 与铝粉反应放出氢气的无色溶液中:NO3-、Mg2+,Na+、SO42- | |
| C. | 0.1 mol•L-1 FeCl3溶液:K+、NH4+、Cl-、S2- | |
| D. | 在无色透明溶液中:Ba2+、Ca2+、NO3-、Cl- |
7.下列各项中表达正确的是( )
| A. | H、D、T表示同一种核素 | B. | F的结构示意图: | ||
| C. | Na2O的电子式: | D. | MgCl2的形成过程: |
4.某同学完成如下实验.
(1)实验记录(请补全表格中空格)
(2)该实验的目的是比较氯、溴、碘单质氧化性强弱(或比较氯、溴、碘元素非金属性强弱).
(3)氯、溴、碘单质氧化性逐渐减弱的原因:同主族元素,最外层电子数相同,从上到下,电子层数增多,原子半径增大,得电子能力逐渐减弱.
(1)实验记录(请补全表格中空格)
| 实验步骤 | 实验现象 | 离子方程式 |
 | ①溶液分层 ②下层呈橙色. | Cl2+2Br-═Br2+2Cl- |
 | ①溶液分层 ②下层呈紫色 | Br2+2I-=I2+2Br- |
(3)氯、溴、碘单质氧化性逐渐减弱的原因:同主族元素,最外层电子数相同,从上到下,电子层数增多,原子半径增大,得电子能力逐渐减弱.
7.下列措施不利于金属防护的是( )
| A. | 在铁塔的表面喷油漆 | B. | 将钢铁制成不锈钢 | ||
| C. | 将钢铁与电源的正极相连 | D. | 埋在地下的钢管与锌块连接 |