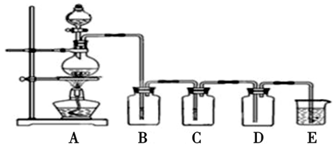
题目内容
12.下列有关说法正确的是( )| A. | 活化分子之间发生的碰撞一定为有效碰撞 | |
| B. | 升高温度,降低反应的活化能,可使活化分子的百分数增大,因而反应速率增大 | |
| C. | 金属腐蚀就是金属失去电子被氧化的过程 | |
| D. | 电解法精炼铜时,以粗铜作阳极,粗铜中的所有金属都以离子的形式进入电解质溶液 |
分析 A.活化分子有合适取向时的碰撞才是有效碰撞;
B.升高温度,活化能不变;
C.金属失去电子而被氧化,为腐蚀的原理;
D.粗铜中含有金、银等金属.
解答 解:A.活化分子有合适取向时的碰撞才是有效碰撞,活化分子之间发生的碰撞不一定为有效碰撞,故A错误;
B.加入催化剂可降低活化能,但升高温度,活化能不变,故B错误;
C.金属单质只具有还原性,失去电子而被氧化,为腐蚀的原理,故C正确;
D.粗铜中含有金、银等金属,在电解时沉积在阳极,不参与电极反应,故D错误.
故选C.
点评 本题考查反应速率的影响因素以及金属的腐蚀、电解等,为高频考点,侧重于学生的分析能力和基本理论知识的综合理解和运用的考查,注意把握相关基础知识的积累,难度不大.

练习册系列答案
相关题目
2.下列表达方式错误的是( )
| A. | 氟化钠的电子式为  | B. | 氯原子的结构示意图: | ||
| C. | CO2分子的结构式:O=C=O | D. | 甲烷的电子式  |
20.常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A. | 1.0mol•L-lKNO3溶液:H+、Fe2+、Cl-、SO42- | |
| B. | 与铝粉反应放出氢气的无色溶液中:NO3-、Mg2+,Na+、SO42- | |
| C. | 0.1 mol•L-1 FeCl3溶液:K+、NH4+、Cl-、S2- | |
| D. | 在无色透明溶液中:Ba2+、Ca2+、NO3-、Cl- |
7.下列各项中表达正确的是( )
| A. | H、D、T表示同一种核素 | B. | F的结构示意图: | ||
| C. | Na2O的电子式: | D. | MgCl2的形成过程: |
17.下列变化中,属于物理变化的是( )
| A. | 从石油中分馏出汽油 | B. | 煤的气化制水煤气 | ||
| C. | 煤的干馏制焦炭 | D. | 油脂的水解制肥皂 |
4.某同学完成如下实验.
(1)实验记录(请补全表格中空格)
(2)该实验的目的是比较氯、溴、碘单质氧化性强弱(或比较氯、溴、碘元素非金属性强弱).
(3)氯、溴、碘单质氧化性逐渐减弱的原因:同主族元素,最外层电子数相同,从上到下,电子层数增多,原子半径增大,得电子能力逐渐减弱.
(1)实验记录(请补全表格中空格)
| 实验步骤 | 实验现象 | 离子方程式 |
 | ①溶液分层 ②下层呈橙色. | Cl2+2Br-═Br2+2Cl- |
 | ①溶液分层 ②下层呈紫色 | Br2+2I-=I2+2Br- |
(3)氯、溴、碘单质氧化性逐渐减弱的原因:同主族元素,最外层电子数相同,从上到下,电子层数增多,原子半径增大,得电子能力逐渐减弱.
3.溴酸银(ASBrO3)溶解度随温度变化曲线如图所示.下列说法正确的是( )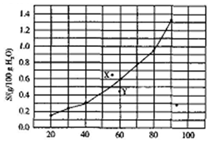

| A. | 溴酸银的溶解是一个熵增、焓减过程 | |
| B. | 对应温度下,X点的分散系中,V(溶解)>v(沉淀) | |
| C. | Y点的分散系中,c(Ag+)•c(BrO3-)>6.25×10-4 | |
| D. | 60℃时溴酸银饱和溶液中c(BrO3-)=0.025mol•L-1 |