题目内容
16.对于化学平衡与化学反应速率关系的叙述正确的是( )| A. | 化学反应速率变化时,化学平衡一定发生移动 | |
| B. | 化学平衡发生移动时,化学反应速率一定变化 | |
| C. | 正反应进行的程度大,正反应速率一定大 | |
| D. | 化学反应速率变化而化学平衡不移动的情况,只有使用催化剂条件下才会发生 |
分析 化学平衡是否发生变化,取决于正逆反应速率的关系,如正逆反应速率相等,则平衡不移动,如正反应速率大于逆反应速率,平衡向正反应方向移动,否则向逆反应方向移动,以此解答该题.
解答 解:A.正逆反应速率都变化但仍相等,则平衡不移动,故A错误;
B.化学平衡发生移动时,正逆反应速率不等,一定发生变化,故B正确;
C.反应进行程度大小,与反应速率没有关系,故C错误;
D.如反应前后气体的体积不变,增大压强,平衡也不移动,故D错误.
故选B.
点评 本题考查化学平衡与反应速率的关系,为高频考点,侧重考查学生的分析能力,题目难度不大,注意反应是否处于平衡状态,取决于正逆反应速率的大小关系.

练习册系列答案
 活力课时同步练习册系列答案
活力课时同步练习册系列答案 学业测评一课一测系列答案
学业测评一课一测系列答案
相关题目
6.下列物质中,能使FeCl3溶液呈紫色的是( )
| A. | CH3CH2OH | B. |  | C. |  | D. |  |
7.下列各项中表达正确的是( )
| A. | H、D、T表示同一种核素 | B. | F的结构示意图: | ||
| C. | Na2O的电子式: | D. | MgCl2的形成过程: |
4.某同学完成如下实验.
(1)实验记录(请补全表格中空格)
(2)该实验的目的是比较氯、溴、碘单质氧化性强弱(或比较氯、溴、碘元素非金属性强弱).
(3)氯、溴、碘单质氧化性逐渐减弱的原因:同主族元素,最外层电子数相同,从上到下,电子层数增多,原子半径增大,得电子能力逐渐减弱.
(1)实验记录(请补全表格中空格)
| 实验步骤 | 实验现象 | 离子方程式 |
 | ①溶液分层 ②下层呈橙色. | Cl2+2Br-═Br2+2Cl- |
 | ①溶液分层 ②下层呈紫色 | Br2+2I-=I2+2Br- |
(3)氯、溴、碘单质氧化性逐渐减弱的原因:同主族元素,最外层电子数相同,从上到下,电子层数增多,原子半径增大,得电子能力逐渐减弱.
11.下列物质的性质比较不正确的( )
| A. | 热稳定性:HCl>HBr | B. | 沸点:H2O>H2S | ||
| C. | 碱性:Ca(OH)2>Mg(OH)2 | D. | 酸性:H3PO4>H2SO4 |
3.溴酸银(ASBrO3)溶解度随温度变化曲线如图所示.下列说法正确的是( )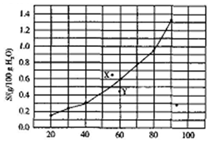

| A. | 溴酸银的溶解是一个熵增、焓减过程 | |
| B. | 对应温度下,X点的分散系中,V(溶解)>v(沉淀) | |
| C. | Y点的分散系中,c(Ag+)•c(BrO3-)>6.25×10-4 | |
| D. | 60℃时溴酸银饱和溶液中c(BrO3-)=0.025mol•L-1 |
10.短周期主族元素 X、Y、Z、W的原子序数依次增大,X原子最外层电子比次外层多4个,Y、Z为相邻金属元素,Z的简单离子半径在同周期元素中最小,W与X同族.下列说法不正确的是( )
| A. | Z元素与氯元素通过离子键化合形成对应的氯化物 | |
| B. | 原子半径:Y>Z>W>X | |
| C. | Y 的最高价氧化物对应的水化物可溶于氯化铵溶液 | |
| D. | 气态氢化物的热稳定性:X>W |
7.下列措施不利于金属防护的是( )
| A. | 在铁塔的表面喷油漆 | B. | 将钢铁制成不锈钢 | ||
| C. | 将钢铁与电源的正极相连 | D. | 埋在地下的钢管与锌块连接 |
8.下列说法正确的是( )
| A. | pH=0的溶液中:NO3-、SO42-、Na+、I-能大量共存 | |
| B. | 0.1mol•L-1Na2S溶液中:c(Na+)=2c(S2-) | |
| C. | NaHSO3溶液中:c(HSO3-)+c(OH-)+c(SO32-)=c(H+)+c(Na+) | |
| D. | 等体积的硝酸和氨水混合可能存在:c(NO3-)=c(NH4+) |