题目内容
将8.0克氧化铜粉末,溶解于2L的盐酸中,再加入过量的铁粉,充分反应后过滤,同时收集到2.24L标准状况下的氢气,则该反应过程中涉及到的所有反应的离子方程式为 ,所用盐酸的物质的量浓度为 .
考点:铁的化学性质,离子方程式的书写,化学方程式的有关计算
专题:计算题
分析:发生CuO+2H+=H2O+Cu2+、Fe+Cu2+=Fe2++Cu、Fe+2H+=H2↑+Fe2+,n(Cu0)=
=0.1mol,n(H2)=
=0.1mol,结合反应及c=
计算.
| 8.0g |
| 80g/mol |
| 2.24L |
| 22.4L/mol |
| n |
| V |
解答:
解:n(Cu0)=
=0.1mol,n(H2)=
=0.1mol,
发生CuO+2H+=H2O+Cu2+、Fe+Cu2+=Fe2++Cu、Fe+2H+=H2↑+Fe2+,
则Fe+2H+=H2↑+Fe2+,
0.2mol 0.1mol
CuO+2H+=H2O+Cu2+,
0.1mol 0.2mol
所所以n(HCl)=0.2mol+0.2mol=0.4mol,
c(HCl)=
=0.2mol?L-1,
故答案为:CuO+2H+=H2O+Cu2+、Fe+Cu2+=Fe2++Cu、Fe+2H+=H2↑+Fe2+;0.2mol?L-1.
| 8.0g |
| 80g/mol |
| 2.24L |
| 22.4L/mol |
发生CuO+2H+=H2O+Cu2+、Fe+Cu2+=Fe2++Cu、Fe+2H+=H2↑+Fe2+,
则Fe+2H+=H2↑+Fe2+,
0.2mol 0.1mol
CuO+2H+=H2O+Cu2+,
0.1mol 0.2mol
所所以n(HCl)=0.2mol+0.2mol=0.4mol,
c(HCl)=
| 0.4mol |
| 2L |
故答案为:CuO+2H+=H2O+Cu2+、Fe+Cu2+=Fe2++Cu、Fe+2H+=H2↑+Fe2+;0.2mol?L-1.
点评:本题考查铁的化学性质及利用反应的计算,为高频考点,把握发生的离子反应及物质的量的关系为解答的关键,侧重分析、计算能力的考查,题目难度不大.

练习册系列答案
相关题目
下列四种装置(电解质溶液皆为海水)中的铁电极腐蚀速率从快到慢顺序为( )


| A、②③④① | B、②③①④ |
| C、①④③② | D、①②③④ |
在标准状况下,用铂电极电解CuSO4溶液,当阴极产生12.8g铜时,阳极放出的气体是( )
| A、1.12L H2 |
| B、1.12L O2 |
| C、2.24L H2 |
| D、2.24L O2 |
 已知A、D为短周期单质,B、C是短周期元素的化合物,关系如图.
已知A、D为短周期单质,B、C是短周期元素的化合物,关系如图.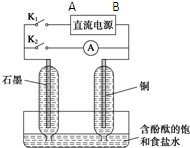 某兴趣小组设计如图微型实验装置.实验时,先断开K2,闭合K1,两极均有气泡产生;一段时间后,断开K1,闭合K2,发现电流表A指针偏转.
某兴趣小组设计如图微型实验装置.实验时,先断开K2,闭合K1,两极均有气泡产生;一段时间后,断开K1,闭合K2,发现电流表A指针偏转.