题目内容
X、Y、Z、M、W为原子序数依次增大的5种短周期元素.X的质子总数与电子层数相同,Y、Z、M同周期且相邻,W原子核外电子数是M原子最外层电子数的2倍.Z与其同主族的短周期元素可形成常见气体甲.X、Y、Z 3种元素形成化合物乙.下列说法不正确的是( )
| A、原子半径:W>Y>Z>M>X |
| B、化合物乙中一定只有共价键 |
| C、W元素是一种亲氧元素 |
| D、X分别与Y、Z、M、W形成的常见化合物中,稳定性最好的是XM,沸点X2Z>XM |
考点:原子结构与元素周期律的关系
专题:元素周期律与元素周期表专题
分析:X、Y、Z、M、W为原子序数依次增大的5种短周期元素.X的质子总数与电子层数相同,则X为H元素;Y、Z、M同周期且相邻,W原子核外电子数是M原子最外层电子数的2倍,而Z与其同主族的短周期元素可形成常见气体甲(甲有刺激性气味),则Z为O元素,可推知Y为N元素、M为F元素、W为Si,故甲为SO2,X、Y、Z 三种元素形成化合物乙为HNO3、NH4NO3等.
解答:
解:X、Y、Z、M、W为原子序数依次增大的5种短周期元素.X的质子总数与电子层数相同,则X为H元素;Y、Z、M同周期且相邻,W原子核外电子数是M原子最外层电子数的2倍,而Z与其同主族的短周期元素可形成常见气体甲(甲有刺激性气味),则Z为O元素,可推知Y为N元素、M为F元素、W为Si,故甲为SO2,X、Y、Z 三种元素形成化合物乙为HNO3、NH4NO3等,
A.同周期自左而右原子半径减小,电子层越多原子半径越大,故原子半径Si>N>O>F>H,故A正确;
B.化合物乙若为NH4NO3,属于离子晶体,含有离子键,若为HNO3,只含共价键,故B错误;
C.W为Si元素,是一种亲氧元素,故C正确;
D.非金属性F最强,故氢化物中HF最稳定,常温下水为液态,而HF为气体,故沸点H2O>HF,故D正确;
故选B.
A.同周期自左而右原子半径减小,电子层越多原子半径越大,故原子半径Si>N>O>F>H,故A正确;
B.化合物乙若为NH4NO3,属于离子晶体,含有离子键,若为HNO3,只含共价键,故B错误;
C.W为Si元素,是一种亲氧元素,故C正确;
D.非金属性F最强,故氢化物中HF最稳定,常温下水为液态,而HF为气体,故沸点H2O>HF,故D正确;
故选B.
点评:本题考查结构性质位置关系应用,难度中等,推断元素是解题关键,注意乙物质的不确定性,注意对元素周期律的理解掌握.

练习册系列答案
相关题目
下列说法正确的是( )
| A、在我们常用的元素周期表中,元素被划分为两类:金属元素和非金属元素 |
| B、在元素周期表中,每个纵列的价电子层的电子总数一定相等 |
| C、在元素周期表里,主族元素所在的族序数等于原子核外电子数 |
| D、在元素周期表中,s区,d区和ds区的元素都是金属元素 |
下列事实与胶体性质无关的是( )
| A、向豆浆中加入盐卤做豆腐 |
| B、长江三角洲、珠江三角洲的形成 |
| C、一束平行光线射入蛋白质溶液里,从侧面可以看到一束光亮的通路 |
| D、向石灰水中通入二氧化碳气体产生白色浑浊 |
某状况下,2gCO2 气体的体积是1120ml,2gA气体的体积是770ml,则A的相对分子质量为( )
| A、48 | B、64 | C、72 | D、56 |
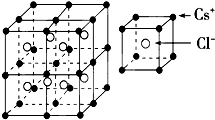 根据如图推测,CsCl晶体中两距离最近的Cs+间距离为a,则每个Cs+周围与其距离为a的Cs+数目为
根据如图推测,CsCl晶体中两距离最近的Cs+间距离为a,则每个Cs+周围与其距离为a的Cs+数目为