题目内容
以锌锰废电池中的碳包(含碳粉、Fe、Cu、Ag和MnO2等物质 )为原料回收MnO2的工艺流程如下:
I.将碳包中物质烘干,用足量稀HNO3溶解金属单质,过滤,得滤渣a;
Ⅱ.将滤渣a在空气中灼烧除去碳粉,得到粗MnO2;
Ⅲ.向粗MnO2中加入酸性H2O2溶液,MnO2溶解生成Mn2+,有气体生成;
Ⅳ.向III所得溶液(pH约为6)中缓慢滴加0.50mol?L-1 Na2CO3溶液,过滤,得滤渣b,其主要成分为
MnCO3;
V.滤渣b经洗涤、干燥、灼烧,制得较纯的MnO2.
(1)Ⅰ中Ag与足量稀HNO3反应生成NO的化学方程式为 .
(2)已知Ⅱ的灼烧过程中同时发生反应:
MnO2(s)+C(s)═MnO(s)+CO(g)△H=+24.4kJ?mol- 1
MnO2(s)+CO(g)═MnO(s)+CO2(g)△H=-148.1kJ?mol- 1
写出MnO2和C反应生成MnO和CO2的热化学方程式: .
(3)H2O2分子中含有的化学键类型为 、 .
(4)Ⅲ中MnO2溶解的化学方程式为 ,溶解一定量的MnO2,H2O2的实际消耗量比理论值高,用化学方程式解释原因: .
(5)Ⅳ中,若改为“向0.50mol?L-1 Na2CO3溶液中缓慢滴加Ⅲ所得溶液”,滤渣b中会混有较多Mn(OH)2沉淀,解释其原因: .
(6)V中MnCO3在空气中灼烧的化学方程式为 .
I.将碳包中物质烘干,用足量稀HNO3溶解金属单质,过滤,得滤渣a;
Ⅱ.将滤渣a在空气中灼烧除去碳粉,得到粗MnO2;
Ⅲ.向粗MnO2中加入酸性H2O2溶液,MnO2溶解生成Mn2+,有气体生成;
Ⅳ.向III所得溶液(pH约为6)中缓慢滴加0.50mol?L-1 Na2CO3溶液,过滤,得滤渣b,其主要成分为
MnCO3;
V.滤渣b经洗涤、干燥、灼烧,制得较纯的MnO2.
(1)Ⅰ中Ag与足量稀HNO3反应生成NO的化学方程式为
(2)已知Ⅱ的灼烧过程中同时发生反应:
MnO2(s)+C(s)═MnO(s)+CO(g)△H=+24.4kJ?mol- 1
MnO2(s)+CO(g)═MnO(s)+CO2(g)△H=-148.1kJ?mol- 1
写出MnO2和C反应生成MnO和CO2的热化学方程式:
(3)H2O2分子中含有的化学键类型为
(4)Ⅲ中MnO2溶解的化学方程式为
(5)Ⅳ中,若改为“向0.50mol?L-1 Na2CO3溶液中缓慢滴加Ⅲ所得溶液”,滤渣b中会混有较多Mn(OH)2沉淀,解释其原因:
(6)V中MnCO3在空气中灼烧的化学方程式为
考点:物质分离和提纯的方法和基本操作综合应用
专题:实验设计题
分析:(1)稀硝酸具有强的氧化性,与银反应生成硝酸银和一氧化氮和水,依据得失电子书写并配平方程式;
(2)依据盖斯定律,将已知热化学方程式进行混合运算求目标热方程式;
(3)同种非金属元素之间易形成非极性共价键,不同非金属元素之间易形成极性共价键;
(4)双氧水与二氧化锰发生氧化还原反应;同时在二氧化锰做催化剂条件下,双氧水发生分解生成水和氧气;
(5)改为向0.50mol?L-1 Na2CO3溶液中缓慢滴加Mn2+溶液,CO32-的水解平衡正向移动生成Mn (OH)2沉淀;
(6)碳酸锰在空气中灼烧,能够被空气中的氧气氧化,反应生成二氧化锰和氧气.
(2)依据盖斯定律,将已知热化学方程式进行混合运算求目标热方程式;
(3)同种非金属元素之间易形成非极性共价键,不同非金属元素之间易形成极性共价键;
(4)双氧水与二氧化锰发生氧化还原反应;同时在二氧化锰做催化剂条件下,双氧水发生分解生成水和氧气;
(5)改为向0.50mol?L-1 Na2CO3溶液中缓慢滴加Mn2+溶液,CO32-的水解平衡正向移动生成Mn (OH)2沉淀;
(6)碳酸锰在空气中灼烧,能够被空气中的氧气氧化,反应生成二氧化锰和氧气.
解答:
解:(1)稀硝酸与银反应生成硝酸银和一氧化氮和水,方程式为:3Ag+4HNO3═3AgNO3+NO↑+2H2O;
故答案为:3Ag+4HNO3═3AgNO3+NO↑+2H2O;
(2)①MnO2(s)+C(s)═MnO(s)+CO(g)△H=+24.4kJ?mol-1
②MnO2(s)+CO(g)═MnO(s)+CO2(g)△H=-148.1kJ?mol-1
依据盖斯定律:①+②得:2MnO2(s)+C(s)═2MnO(s)+CO2(g)△H=-123.7 kJ?mol-1
故答案为:2MnO2(s)+C(s)═2MnO(s)+CO2(g)△H=-123.7 kJ?mol-1;
(3)过氧化氢中存在H-O极性共价键,O-O非极性共价键;
故答案为:极性键、非极性键;
(4)双氧水与二氧化锰发生氧化还原反应,方程式为:MnO2+H2O2+2H+═Mn2++O2↑+2H2O;
同时在二氧化锰做催化剂条件下,双氧水发生分解生成水和氧气,方程式为:2H2O2═O2↑+2H2O,所以H2O2的实际消耗量比理论值高;
故答案为:MnO2+H2O2+2H+═Mn2++O2↑+2H2O; 2H2O2═O2↑+2H2O;
(5)碳酸钠为强碱弱酸盐存在碳酸根离子的水解平衡:CO32-+H2O HCO3-+OH-,所以Na2CO3溶液pH>7显碱性,III所得溶液pH约为6 显弱酸性(1分),后者滴加到前者中,溶液中c(OH-)较大,Mn2+与OH-生成Mn (OH)2沉淀;
故答案为:Na2CO3溶液pH>7显碱性,III所得溶液pH约为6 显弱酸性,后者滴加到前者中,溶液中c(OH-)较大,Mn2+与OH-生成Mn (OH)2沉淀;
(6)MnCO3在空气中灼烧生成二氧化锰和二氧化碳,化学方程式为:2MnCO3+O2═2MnO2+2CO2;
故答案为:2MnCO3+O2═2MnO2+2CO2.
故答案为:3Ag+4HNO3═3AgNO3+NO↑+2H2O;
(2)①MnO2(s)+C(s)═MnO(s)+CO(g)△H=+24.4kJ?mol-1
②MnO2(s)+CO(g)═MnO(s)+CO2(g)△H=-148.1kJ?mol-1
依据盖斯定律:①+②得:2MnO2(s)+C(s)═2MnO(s)+CO2(g)△H=-123.7 kJ?mol-1
故答案为:2MnO2(s)+C(s)═2MnO(s)+CO2(g)△H=-123.7 kJ?mol-1;
(3)过氧化氢中存在H-O极性共价键,O-O非极性共价键;
故答案为:极性键、非极性键;
(4)双氧水与二氧化锰发生氧化还原反应,方程式为:MnO2+H2O2+2H+═Mn2++O2↑+2H2O;
同时在二氧化锰做催化剂条件下,双氧水发生分解生成水和氧气,方程式为:2H2O2═O2↑+2H2O,所以H2O2的实际消耗量比理论值高;
故答案为:MnO2+H2O2+2H+═Mn2++O2↑+2H2O; 2H2O2═O2↑+2H2O;
(5)碳酸钠为强碱弱酸盐存在碳酸根离子的水解平衡:CO32-+H2O HCO3-+OH-,所以Na2CO3溶液pH>7显碱性,III所得溶液pH约为6 显弱酸性(1分),后者滴加到前者中,溶液中c(OH-)较大,Mn2+与OH-生成Mn (OH)2沉淀;
故答案为:Na2CO3溶液pH>7显碱性,III所得溶液pH约为6 显弱酸性,后者滴加到前者中,溶液中c(OH-)较大,Mn2+与OH-生成Mn (OH)2沉淀;
(6)MnCO3在空气中灼烧生成二氧化锰和二氧化碳,化学方程式为:2MnCO3+O2═2MnO2+2CO2;
故答案为:2MnCO3+O2═2MnO2+2CO2.
点评:本题为综合题,考查了方程式的书写、反应热的计算、化学平衡的移动,题目难度较大,熟悉相关知识是解题关键,注意盖斯定律求反应热的方法.

练习册系列答案
 活力课时同步练习册系列答案
活力课时同步练习册系列答案 学业测评一课一测系列答案
学业测评一课一测系列答案
相关题目
在0.5mol Na2SO4中含有Na+的数目是( )
| A、0.5个 |
| B、6.02×1023个 |
| C、3.01×1023个 |
| D、1个 |
500mL含有0.40mol碳酸钠的溶液和某浓度的400mL盐酸,不管将前者滴加入后者,还是将后者滴加入前者,都有气体产生,但最终生成的气体体积不同,则盐酸的浓度合理的是( )
| A、1.2mol/L |
| B、2 mol/L |
| C、0.2 mol/L |
| D、0.4mol/L |
关于酸、碱、盐的定义,下列各种说法中正确的是( )
| A、化合物电离出的阳离子有氢离子的就是酸 | ||
| B、化合物电离出的阴离子有氢氧根离子的就是碱 | ||
| C、盐电离出的阳离子不一定都是金属阳离子 | ||
D、NH4Cl电离的电离方程式是NH4Cl═NH
|

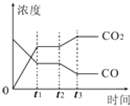 Ⅰ、对于反应CO(g)+H2O(g)?H2(g)+CO2(g)
Ⅰ、对于反应CO(g)+H2O(g)?H2(g)+CO2(g) 太阳能电池是通过光电效应或者光化学效应直接把光能转化成电能的装置.其材料除单晶硅,还有铜铟镓硒等化合物.
太阳能电池是通过光电效应或者光化学效应直接把光能转化成电能的装置.其材料除单晶硅,还有铜铟镓硒等化合物.