题目内容
 太阳能电池是通过光电效应或者光化学效应直接把光能转化成电能的装置.其材料除单晶硅,还有铜铟镓硒等化合物.
太阳能电池是通过光电效应或者光化学效应直接把光能转化成电能的装置.其材料除单晶硅,还有铜铟镓硒等化合物.(1)镓的基态原子的电子排布式是
(2)与镓元素处于同一主族的硼元素具有缺电子性,其化合物往往具有加合性,因而硼酸(H3BO3)在水溶液中能与水反应生成[B(OH)4]-而体现一元弱酸的性质,则[B(OH)4]-中B的原子杂化类型为
(3)硒为第4周期元素,相邻的元素有砷和溴,则3种元素的第一电离能从大到小顺序为
(4)金属Cu单独与氨水或单独与过氧化氢都不能反应,但可与氨水和过氧化氢的混合溶液反应,反应的离子方程式为
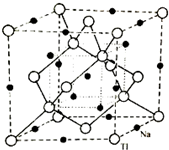
(5)铊(Tl)与镓同主族,铊与钠形成化合物的晶胞结构如图,该物质化学式为
考点:晶胞的计算,原子核外电子排布,判断简单分子或离子的构型,原子轨道杂化方式及杂化类型判断
专题:化学键与晶体结构
分析:(1)镓是31号元素,根据原子核外电子排布规律可以写出电子排布式;
(2)根据价层电子对互斥理论确定其杂化方式;
(3)砷、硒、溴三种元素都是第4周期非金属元素,同一周期元素自左而右第一电离能呈增大趋势,但砷元素原子4p能级是半满稳定状态,能量较低,第一电离能高于同周期相邻元素,故第一电离能Br>As>Se;气态SeO3分子中中心原子的价层电子对数可以判断分子构型;
(4)根据氧化还原反应中元素和电荷守恒,可写出离子方程式;根据六方最密堆积和面心立方堆积的结构特点确定密度之比;
(5)利用均摊法确定晶胞中各种原子的个数,再确定化学式;根据晶胞结构图确定Na离子的空间结构;根据ρ=
计算密度;
(2)根据价层电子对互斥理论确定其杂化方式;
(3)砷、硒、溴三种元素都是第4周期非金属元素,同一周期元素自左而右第一电离能呈增大趋势,但砷元素原子4p能级是半满稳定状态,能量较低,第一电离能高于同周期相邻元素,故第一电离能Br>As>Se;气态SeO3分子中中心原子的价层电子对数可以判断分子构型;
(4)根据氧化还原反应中元素和电荷守恒,可写出离子方程式;根据六方最密堆积和面心立方堆积的结构特点确定密度之比;
(5)利用均摊法确定晶胞中各种原子的个数,再确定化学式;根据晶胞结构图确定Na离子的空间结构;根据ρ=
| m |
| V |
解答:
解:(1)镓是31号元素,根据原子核外电子排布规律可以写出电子排布式为:1s22s22p63s23p63d104s24p1(或[Ar]3d104s24p1),
故答案为:1s22s22p63s23p63d104s24p1(或[Ar]3d104s24p1);
(2)[B(OH)4]-中B的价层电子对=4+
(3+1-4×1)=4,所以采取sp3杂化,故答案为:sp3;
(3)砷、硒、溴三种元素都是第4周期非金属元素,同一周期元素自左而右第一电离能呈增大趋势,但砷元素原子4p能级是半满稳定状态,能量较低,第一电离能高于同周期相邻元素,故第一电离能Br>As>Se;气态SeO3分子中中心原子的价层电子对数为
=3,无孤电子对,所以分子构型为平面三角形,
故答案为:Br>As>Se;平面三角形;
(4)金属Cu单独与氨水或单独与过氧化氢都不能反应,但可与氨水和过氧化氢的混合溶液反应,说明两者能互相促进,是两种物质共同作用的结果,其中过氧化氢为氧化剂,氨与Cu2+形成配离子,两者相互促进使反应进行,方程式可表示为:Cu+H2O2+4NH3=[Cu(NH3)4]2++2OH-;由于铜的六方最密堆积和面心立方堆积中原子的配位数都是12,原子利用率都为74%,所以它们的密度之比为1:1,故答案为:Cu+H2O2+4NH3=[Cu(NH3)4]2++2OH-;1:1;
(5)根据均摊法可知晶胞中铊原子的个数为8×
+6×
+4=8,钠原子的个数为12×
+5=8,它们的原子个数比为1:1,所以该物质化学式为NaTl,根据晶胞的结构图可知,有12个钠原子分布在晶胞的棱边中点、1个钠原子在晶胞的体心上、将晶胞均分成八个小立方体,有4个钠原子分布在互不相邻的小立方体的体心,这种结构与金刚石或者晶体硅的结构相似;根据晶胞的结构图可知,晶胞的体对角线的长度为Na、Tl最近距离的4倍,所以晶胞的边长为
a pm,因为在每佣晶胞中含有8个铊原子和8个钠原子,根据ρ=
可计算得密度为
g/cm3=
g/cm3,
故答案为:NaTl;金刚石或者晶体硅;
g/cm3.
故答案为:1s22s22p63s23p63d104s24p1(或[Ar]3d104s24p1);
(2)[B(OH)4]-中B的价层电子对=4+
| 1 |
| 2 |
(3)砷、硒、溴三种元素都是第4周期非金属元素,同一周期元素自左而右第一电离能呈增大趋势,但砷元素原子4p能级是半满稳定状态,能量较低,第一电离能高于同周期相邻元素,故第一电离能Br>As>Se;气态SeO3分子中中心原子的价层电子对数为
| 6+0 |
| 2 |
故答案为:Br>As>Se;平面三角形;
(4)金属Cu单独与氨水或单独与过氧化氢都不能反应,但可与氨水和过氧化氢的混合溶液反应,说明两者能互相促进,是两种物质共同作用的结果,其中过氧化氢为氧化剂,氨与Cu2+形成配离子,两者相互促进使反应进行,方程式可表示为:Cu+H2O2+4NH3=[Cu(NH3)4]2++2OH-;由于铜的六方最密堆积和面心立方堆积中原子的配位数都是12,原子利用率都为74%,所以它们的密度之比为1:1,故答案为:Cu+H2O2+4NH3=[Cu(NH3)4]2++2OH-;1:1;
(5)根据均摊法可知晶胞中铊原子的个数为8×
| 1 |
| 8 |
| 1 |
| 2 |
| 1 |
| 4 |
| 4 | ||
|
| m |
| V |
| ||||
(
|
681
| ||
| 8×10-30a3NA |
故答案为:NaTl;金刚石或者晶体硅;
681
| ||
| 8×10-30a3NA |
点评:本题主要考查核外电子排布、原子的杂化、配合物、晶胞的结构及计算等知识点,中等难度,解题的难点在于对晶胞结构的观察和空间想象.

练习册系列答案
相关题目
下列指定粒子的个数比为1:2的是( )
| A、Be2+中的质子和电子 | ||
B、
| ||
| C、NaHCO3中的阳离子和阴离子 | ||
| D、Na2O2中的阴离子和阳离子 |
可以证明乙酸是弱酸的事实是( )
| A、乙酸和水能任意比例混溶 |
| B、乙酸水溶液能使紫色石蕊试液变红色 |
| C、醋酸能与碳酸钠溶液反应生成CO2气体 |
| D、在25℃时,1mol/L的CH3COONa溶液的pH约为9 |

 高铁酸钾(K2FeO4)是一种高效多功能水处理剂,具有极强的氧化性.
高铁酸钾(K2FeO4)是一种高效多功能水处理剂,具有极强的氧化性. 的名称是
的名称是 工业上电解制碱的技术是用离子交换膜法,主要原料是饱和食盐水.如图为离子交换膜法电解原理示意图:
工业上电解制碱的技术是用离子交换膜法,主要原料是饱和食盐水.如图为离子交换膜法电解原理示意图: