题目内容
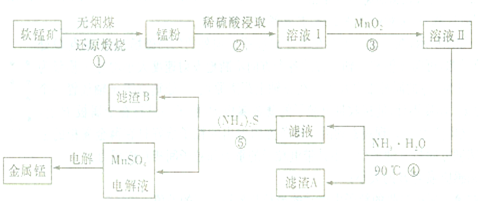
10.锰锌铁氧体可用于隐形飞机上吸收雷达波涂料.现以废旧锌锰电池为原料制备锰锌铁氧体的主要流程如下: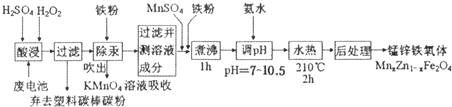
(1)酸浸时,二氧化锰被双氧水还原的化学方程式为MnO2+H2O2+H2SO4=MnSO4+O2↑+2H2O.
(2)活性铁粉除汞时,铁粉的作用是还原剂(填“氧化剂”或“还原剂”或“吸附剂”).
(3)除汞是以氮气为载气吹入滤液带出汞蒸汽经KMn04溶液进行吸收而实现的. 如图是KMnO4溶液处于不同pH时对应的Hg去除率变化图,图中物质为Hg与MnO4-在该pH范围内的主要产物.
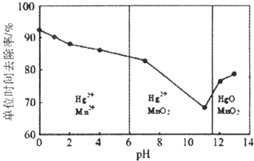
①请根据该图给出pH对汞去除率影响的 变化规律:随pH的升高汞的去除率先降低后增加.
②试猜想在强酸性环境下汞的单位时间去 除率高的原因:Mn2+具有催化作用,单位时间内去除率高.
(4)当x=0.2时,所得到的锰锌铁氧体对 雷达波的吸收能力特别强,试用氧化物的 形式表示该铁氧体组成MnO•4ZnO•5Fe2O3.
(5)经测定滤液成分后同时加入一定量的MnS04和铁粉的目的是调节滤液离子的成分,符合水热后获得锰锌铁氧化体组成.
分析 废电池酸浸得到滤液中液中主要金属阳离子有Mn2+、Hg2+、Zn2+,加入铁粉除Hg,吹出汞蒸汽经KMnO4溶液吸收,除汞后的滤液中含有硫酸锌、硫酸亚铁、硫酸锰等,加入MnSO4和铁粉,调节滤液离子的成分,煮沸除去双氧水,再水热,进行后处理,也能得到锰锌铁氧体.
(1)酸浸时,双氧水被氧化生成氧气,二氧化锰还原生成硫酸锰,反应还有水生成;
(2)利用铁粉把Hg还原出来;
(3)①由图可知,pH<6时Hg与酸性高锰酸钾反应生成Hg2+、Mn2+;
②由图可知,随pH值的升高汞的去除率先降低后增加;
③酸性条件下有Mn2+生成,可能是Mn2+具有催化作用;
(4)Mn为+2价、Zn为+2价,利用化合价代数和为0,计算Fe元素化合价,再结合Mg、Zn、Fe原子数目之比改写为氧化物形式;
(3)除汞后的滤液中含有硫酸锌、硫酸亚铁、硫酸锰、硫酸等,不加入MnSO4和铁粉,进行后续操作,也能得到锰锌铁氧体,而实际中加入需加入一定量的MnSO4和铁粉,应是调节滤液离子的成分,符合水热后获得锰锌铁氧化体组成.
解答 解:废电池酸浸得到滤液中液中主要金属阳离子有Mn2+、Hg2+、Zn2+,加入铁粉除Hg,吹出汞蒸汽经KMnO4溶液吸收,除汞后的滤液中含有硫酸锌、硫酸亚铁、硫酸锰等,加入MnSO4和铁粉,调节滤液离子的成分,煮沸除去双氧水,再水热,进行后处理,也能得到锰锌铁氧体.
(1)酸浸时,双氧水被氧化生成氧气,二氧化锰还原生成硫酸锰,反应还有水生成,反应方程式为:MnO2+H2O2+H2SO4=MnSO4+O2↑+2H2O,
故答案为:MnO2+H2O2+H2SO4=MnSO4+O2↑+2H2O;
(2)铁粉具有还原性,能把汞离子还原为汞单质,所以铁粉的作用是还原剂,故答案为:还原剂;
(3)由图象可知,汞的吸收率随着PH的增大先降低后增加,
故答案为:随pH的升高汞的吸收率先降低后增加;
②不考虑酸性条件下氧化性增强因素,酸性条件下有Mn2+生成,可能是Mn2+具有催化作用,强酸性环境下汞的单位时间去除率高,
故答案为:Mn2+具有催化作用;
(4)Mn为+2价、Zn为+2价,当x=0.2时,利用化合价代数和为0,可知Fe元素化合价为+3,改写为氧化物形式为:MnO•4ZnO•5Fe2O3,
故答案为:MnO•4ZnO•5Fe2O3;
(5)除汞后的滤液中含有硫酸锌、硫酸亚铁、硫酸锰、硫酸等,不加入MnSO4和铁粉,进行后续操作,也能得到锰锌铁氧体,而实际中加入需加入一定量的MnSO4和铁粉,应是调节滤液离子的成分,符合水热后获得锰锌铁氧化体组成,
故答案为:调节滤液离子的成分,符合水热后获得锰锌铁氧化体组成.
点评 本题考查化学工艺流程、物质的分离提纯、对操作的分析评价、读图获取信息能力等,侧重考查学生对知识的迁移运用,难度中等.

 名师导航单元期末冲刺100分系列答案
名师导航单元期末冲刺100分系列答案 名校名卷单元同步训练测试题系列答案
名校名卷单元同步训练测试题系列答案
| A. | 装置①:制取乙炔并验证炔烃的性质;溴水褪色 | |
| B. | 装置②:检验乙醇的氧化性;溶液颜色从绿色变成橙色 | |
| C. | 装置③:验证葡萄糖分子中含有醛基官能团;出现银镜 | |
| D. | 装置④:验证碳酸的酸性比苯酚的酸性强;溶液变浑浊 |
 以铬酸钾为原料,电化学法制备重铬酸钾的实验装置示意图如图,下列说法不正确的是( )
以铬酸钾为原料,电化学法制备重铬酸钾的实验装置示意图如图,下列说法不正确的是( )| A. | 在阴极室,发生的电极反应为:2H2O+2e-═2OH-+H2↑ | |
| B. | 在阳极室,通电后逐渐由黄色变为橙色,是因为阳极取H+浓度增大,使平衡2CrO42-+2H+?Cr2O72-+H2O向右移动 | |
| C. | 该制备过程总反应的化学方程式为:4K2CrO4+4H2O$\frac{\underline{\;通电\;}}{\;}$2K2Cr2O7+4KOH+2H2↑+O2↑ | |
| D. | 通电阳离子交换膜的离子主要是H+离子 |
| A. | n(Cl2):n(Fe)=5:4 5Cl2+4Fe$\frac{\underline{\;点燃\;}}{\;}$2FeCl2+2FeCl3 | |
| B. | n(Cl2):n(FeBr2)=1:1 Fe2++2Br-+Cl2=Fe3++Br2+2Cl- | |
| C. | n(MnO4-):n(H2O2)=2:3 2MnO4-+3H2O2+6H+=2Mn2++4O2↑+6H2O | |
| D. | n(Fe):n[HNO3(稀)]=1:3 4Fe+12H++3NO3-═3Fe2++Fe3++3NO↑+6H2O |
①Na易与O2反应
②Na易与N2反应
③Na易与H2O反应
④Na的密度小于H2O
⑤Na不与煤油反应
⑥煤油比钠的密度小,钠放入其中可与空气隔绝.
| A. | ①②③ | B. | ③④⑥ | C. | ①④⑤ | D. | ①③⑤⑥ |
| A. | KCl | B. | NaCl | C. | AgNO3 | D. | AlCl3 |