题目内容
18. 测定室温下NH3•H2O的浓度及电离平衡常数Kb
测定室温下NH3•H2O的浓度及电离平衡常数Kb(1)从三颈瓶中用碱式滴定管(或移液管)(填仪器名称)量取25.00mL氨水至锥形瓶中,用0.0500mol•L-1HCl滴定.用pH计采集数据、电脑绘制滴定曲线如下图.
(2)据图,计算氨水的浓度为0.0450mol•L-1;写出NH3•H2O电离平衡常数Kb的表达式,Kb=$\frac{[O{H}^{-}]•[N{{H}_{4}}^{+}]}{[N{H}_{3}•{H}_{2}O]}$,当pH=11.0时计算Kb的近似值,Kb≈2.2×10-5.(Kb保留两位有效数字)
(3)关于该滴定实验的说法中,正确的是AC.
A.锥形瓶中有少量蒸馏水不影响测定结果B.未滴加酸碱指示剂,实验结果不科学
C.酸式滴定管未用盐酸润洗会导致测得氨水的浓度偏高D.滴定终点时俯视读数会导致测得氨水的浓度偏高.
分析 (1)可以用移液管或碱式滴定管量取碱性溶液;
(2)氨水的物质的量浓度=$\frac{1}{{V}_{m}}$mol/L=$\frac{1}{22.4}$mol/L=0.0450mol/L;pH=11的氨水中c(OH-)=0.001mol/L,c(OH-)≈c(NH4+)=0.001mol/L,c(NH3•H2O)≈0.0450mol/L,根据Kb=$\frac{[O{H}^{-}]•[N{{H}_{4}}^{+}]}{[N{H}_{3}•{H}_{2}O]}$,计算电离平衡常数;
(3)A.锥形瓶中有少量蒸馏水不影响氨水的物质的量;
B.利用pH计判断滴定终点更准确;
C.酸式滴定管未用盐酸润洗会导致盐酸浓度偏低;
D.滴定终点时俯视读数会导致盐酸物质的量偏小.
解答 解:(1)氨水中含有一水合氨,一水合氨电离出氢氧根离子而使溶液呈碱性,所以用移液管或碱式滴定管量取氨水,
故答案为:碱式滴定管(或移液管);
(2)氨水的物质的量浓度=$\frac{1}{{V}_{m}}$mol/L=$\frac{1}{22.4}$mol/L=0.0450mol/L;pH=11的氨水中c(OH-)=0.001mol/L,c(OH-)≈c(NH4+)=0.001mol/L,c(NH3•H2O)≈0.0450mol/L,根据Kb=$\frac{[O{H}^{-}]•[N{{H}_{4}}^{+}]}{[N{H}_{3}•{H}_{2}O]}$=$\frac{0.001×0.001}{0.045}$=2.2×10-5;
故答案为:0.0450;$\frac{[O{H}^{-}]•[N{{H}_{4}}^{+}]}{[N{H}_{3}•{H}_{2}O]}$;2.2×10-5;
(3)A.锥形瓶中有少量蒸馏水不影响氨水的物质的量,所以不影响测定结果,故A正确;
B.利用pH计判断滴定终点更准确,不需要酸碱指示剂即可,故B错误;
C.酸式滴定管未用盐酸润洗会导致盐酸浓度偏低,则使用盐酸的体积偏大,所以导致测定结果偏高,故C正确;
D.滴定终点时俯视读数会导致盐酸体积偏小,则盐酸物质的量偏小,测定结果偏低,故D错误.
故答案为:AC.
点评 本题考查性质实验,侧重考查学生分析、判断及实验操作能力,明确滴定原理、弱电解质电离等知识点是解本题关键,(3)题A为易错点,题目难度中等.

| A. | 二氧化硅和冰的熔化 | B. | 氯化钠和铁的熔化 | ||
| C. | 烧碱和金刚石的熔化 | D. | 碘和干冰的升华 |
| A. | l2 | B. | NH3(三角锥型) | C. | CO2 | D. | SO2(键角120°) |
| A. | 原子半径:C>D>E>A>B | |
| B. | 常见氢化物的热稳定性:B<E | |
| C. | C可分别与A、B形成共价化合物、离子化合物 | |
| D. | 制备含D、E的二元化合物时,可能需要在无水条件下进行 |
| A. | 氯气作自来水的杀菌消毒剂 | B. | 硅胶作袋装食品的干燥剂 | ||
| C. | 二氧化硫作纸浆的漂白剂 | D. | 大气中的NO2导致酸雨的形成 |
 25℃,有c(CH3COOH)+c(CH3COO-)=0.1mol•L-1的一组醋酸和醋酸钠混合溶液,溶液中c(CH3COOH)、c(CH3COO-)与pH值的关系如图所示.下列有关离子浓度关系叙述正确的是( )
25℃,有c(CH3COOH)+c(CH3COO-)=0.1mol•L-1的一组醋酸和醋酸钠混合溶液,溶液中c(CH3COOH)、c(CH3COO-)与pH值的关系如图所示.下列有关离子浓度关系叙述正确的是( )| A. | pH=5.5溶液中:c(CH3COOH)>c(CH3COO-)>c(H+)>c(OH-) | |
| B. | pH=3.5溶液中:c(Na+)+c(H+)+c(OH-)+c(CH3COOH)=0.1mol•L-1 | |
| C. | 该温度下醋酸的电离平衡常数为10-4.75 | |
| D. | 向W点所表示溶液中加入等体积的0.05 mol•L-1NaOH溶液:c(H+)=c(CH3COOH)+c(OH-) |
| A. | 苯与浓硝酸、浓硫酸共热并保持50~60℃反应生成硝基苯 | |
| B. | 在甲苯中加入少量酸性高锰酸钾溶液,振荡后褪色,正确的解释是由于苯环对侧链的影响,使侧链易被氧化 | |
| C. | 若甲苯苯环上的一个氢原子被一个含3个碳原子的烷基取代,所得产物有6种 | |
| D. | 菲的结构简式为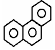 ,它与硝酸反应,可生成3种一硝基取代物 ,它与硝酸反应,可生成3种一硝基取代物 |
| 反应时间t/min | 0 | 1 | 2 | 3 | 4 |
| c(X)/(mol•L-1) | 0.60 | 0.42 | 0.30 | 0.21 | 0.15 |
| A. | 碳酸钠 | B. | 氢氧化钠 | C. | 氧化钠 | D. | 过氧化钠 |