题目内容
17.常温下,将某一元酸HA溶液和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表:| 实验编号 | HA物质的量浓度(mol•L-1) | NaOH物质的量浓度(mol•L-1) | 混合溶液的pH |
| ① | 0.1 | 0.1 | pH=9 |
| ② | c | 0.2 | pH=7 |
| ③ | 0.2 | 0.1 | pH<7 |
(2)在②组实验中c>0.2(填“<”、“>”或“=”).
(3)根据③组实验所得的混合溶液,其溶液中离子浓度大小排列顺序是c(A-)>c(Na+)>c(H+)>c(OH-).
(4)常温下,已知KSP[Cu(OH)2]=2×10-20,某CuSO4溶液里c(Cu2+)=0.02mol•L-1,如果要生成Cu(OH)2沉淀,则应调整溶液pH大于5.
分析 (1)c在①组实验中酸碱恰好完全反应生成盐NaA,混合溶液呈碱性,说明NaA是强碱弱酸盐,则HA是弱酸,酸或碱抑制水电离,含有弱离子的盐促进水电离,且酸中氢离子浓度或碱中氢氧根离子浓度越大,其抑制水电离程度越大;
(2)HA是弱酸、NaOH是强碱,要使混合溶液呈中性,则酸应该稍微过量;
(3)③组实验中溶质为等物质的量浓度的NaA和HA,混合溶液呈酸性,说明HA的电离程度大于酸根离子水解程度,再结合电荷守恒判断离子浓度大小顺序;
(4)常温下,已知KSP[Cu(OH)2]=2×10-20,某CuSO4溶液里c(Cu2+)=0.02mol•L-1,如果要生成Cu(OH)2沉淀,溶液中c(OH-)>$\sqrt{\frac{{K}_{sp}[Cu(OH)_{2}]}{c(C{u}^{2+})}}$.
解答 解:(1)c在①组实验中酸碱恰好完全反应生成盐NaA,混合溶液呈碱性,说明NaA是强碱弱酸盐,则HA是弱酸,酸或碱抑制水电离,含有弱离子的盐促进水电离,且酸中氢离子浓度或碱中氢氧根离子浓度越大,其抑制水电离程度越大,0.1mol/L的HA溶液中氢离子浓度小于0.1mol/LNaOH溶液,所以NaOH抑制水电离程度大于HA,NaA促进水电离,
所以a、b、c由大到小的顺序是c>a>b,
故答案为:cab;
(2)HA是弱酸、NaOH是强碱,要使混合溶液呈中性,则酸应该稍微过量,酸碱的体积相等,则酸浓度大于碱浓度,则c>0.2,故答案为:>;
(3)③组实验中溶质为等物质的量浓度的NaA和HA,混合溶液呈酸性,说明HA的电离程度大于酸根离子水解程度,再结合电荷守恒得c(A-)>c(Na+),酸的电离及酸根离子水解程度都较小,则溶液中离子浓度大小顺序为c(A-)>c(Na+)>c(H+)>c(OH-),
故答案为:c(A-)>c(Na+)>c(H+)>c(OH-);
(4)常温下,已知KSP[Cu(OH)2]=2×10-20,某CuSO4溶液里c(Cu2+)=0.02mol•L-1,如果要生成Cu(OH)2沉淀,溶液中c(OH-)>$\sqrt{\frac{{K}_{sp}[Cu(OH)_{2}]}{c(C{u}^{2+})}}$=$\sqrt{\frac{2×1{0}^{-20}}{0.02}}$mol/L=10-9 mol/L,则溶液中c(H+)=10-5mol/L,溶液的pH=5,
故答案为:5.
点评 本题考查酸碱混合溶液定性判断、难溶物溶解平衡等知识点,为高频考点,侧重考查学生分析判断及计算能力,根据酸的强弱结合混合溶液酸碱性、电荷守恒及溶度积常数等知识点分析解答即可,题目难度不大.

| A. | A和B可能是同分异构体 | |
| B. | A和B不一定是同系物 | |
| C. | A和B完全燃烧后生成的水的质量相等 | |
| D. | A和B含碳的质量分数相同 |
| A. | C2H4 | B. | CH3-CH2-CH2-CH3 | C. | C2H5OH | D. | O2 |
| A. | 乙醇和乙二醇属于同系物 | |
| B. | 1-丁烯存在顺反异构体 | |
| C. | 将苯加入溴水中,溴水褪色,是因为发生了加成反应 | |
| D. | 分子式为C3H8与C6H14的两种有机物一定互为同系物 |
| A. | 甲苯与溴水 | B. | 乙酸钠溶液与硫酸 | ||
| C. | 甲苯与KMnO4酸性溶液 | D. | 甲酸溶液与银氨溶液水浴共热 |
| A. | C2H6与C3H8没有同分异构体,CH2O2与C2H4O2属于同系物 | |
| B. | 一定条件下,乙酸乙酯、淀粉、蛋白质、乙烯都能与水发生水解反应 | |
| C. | 一定条件下,完全燃烧14g含氧质量分数为a的乙烯、乙醛混合气体,则生成水的质量为18(1-a)g | |
| D. | 全降解塑料(  )可由单体环氧丙烷( )可由单体环氧丙烷( )和CO2缩聚制得 )和CO2缩聚制得 |
| A. | 乙醇和乙酸都能与金属钠反应 | |
| B. | 用氢氧化钠除去乙酸乙酯中的少量乙酸 | |
| C. | 植物油和动物脂肪都不能使溴水褪色 | |
| D. | 乙烯和聚乙烯都能使溴的四氯化碳溶液褪色 |
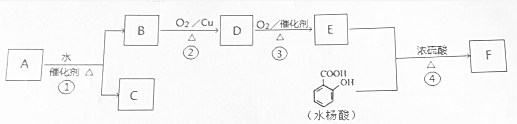
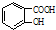 $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$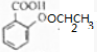 +H2O.
+H2O.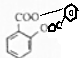 +H2O.
+H2O.