题目内容
6.一定质量的无水乙醇完全燃烧时放出的热量为Q,它所生成的CO2用过量的饱和石灰水完全吸收得100gCaCO3沉淀,则完全燃烧1mol无水乙醇时放出的热量是( )| A. | 0.5Q | B. | Q | C. | 2Q | D. | 5Q |
分析 利用生成的CO2用过量饱和石灰水完全吸收,可得100克CaCO3沉淀可计算出二氧化碳的物质的量,即得出二氧化碳的物质的量与放出的热量的关系,再利用完全燃烧1摩尔无水乙醇生成2摩尔二氧化碳来分析放出的热量.
解答 解:因生成的CO2用过量饱和石灰水完全吸收,可得100克CaCO3沉淀,
CaCO3的物质的量为:$\frac{100g}{100g/mol}$=1mol,
由碳元素守恒可知,二氧化碳的物质的量也为1mol,
即生成1mol二氧化碳放出的热量为Q,
而完全燃烧1mol无水乙醇时生成2mol二氧化碳,
则完全燃烧1mol无水乙醇时放出的热量为:Q×2=2Q,
故选C.
点评 本题考查反应热与焓变的应用,题目难度不大,注意利用化学反应中的元素守恒来分析二氧化碳的量及二氧化碳的量与放出的热量的关系,明确物质的物质的量与热量成正比是解答本题的关键.

练习册系列答案
相关题目
16.有机物的天然提取和人工合成往往得到的是混合物,假设给你一种这样的有机混合物让你研究,一般要采取的几个步骤是( )
| A. | 分离、提纯→确定化学式→确定最简式→确定结构式 | |
| B. | 分离、提纯→确定最简式→确定化学式→确定结构式 | |
| C. | 分离、提纯→确定结构式→确定最简式→确定化学式 | |
| D. | 确定化学式→确定最简式→确定结构式→分离、提纯 |
17.常温下,将某一元酸HA溶液和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表:
(1)在①组实验中0.1mol•L-1HA溶液中水的电离程度为a,0.1mol•L-1NaOH溶液中水的电离程度为b,所得混合溶液中水的电离程度为c.则a、b、c由大到小的顺序是cab.
(2)在②组实验中c>0.2(填“<”、“>”或“=”).
(3)根据③组实验所得的混合溶液,其溶液中离子浓度大小排列顺序是c(A-)>c(Na+)>c(H+)>c(OH-).
(4)常温下,已知KSP[Cu(OH)2]=2×10-20,某CuSO4溶液里c(Cu2+)=0.02mol•L-1,如果要生成Cu(OH)2沉淀,则应调整溶液pH大于5.
| 实验编号 | HA物质的量浓度(mol•L-1) | NaOH物质的量浓度(mol•L-1) | 混合溶液的pH |
| ① | 0.1 | 0.1 | pH=9 |
| ② | c | 0.2 | pH=7 |
| ③ | 0.2 | 0.1 | pH<7 |
(2)在②组实验中c>0.2(填“<”、“>”或“=”).
(3)根据③组实验所得的混合溶液,其溶液中离子浓度大小排列顺序是c(A-)>c(Na+)>c(H+)>c(OH-).
(4)常温下,已知KSP[Cu(OH)2]=2×10-20,某CuSO4溶液里c(Cu2+)=0.02mol•L-1,如果要生成Cu(OH)2沉淀,则应调整溶液pH大于5.
14.设NA为阿伏伽德罗常数的值,下列有关叙述正确的是( )
| A. | 标准状况下,1L庚烷完全燃烧后,所生成的气态产物的分子数为$\frac{7}{22.4}$NA | |
| B. | 100ml 0.1mol/LCH3COOH溶液跟足量锌反应,生成的氢气分子数为0.01NA | |
| C. | 0.1mol CH4所含质子数为NA | |
| D. | 0.5mol C2H4中含有的C=C双键数为NA |
1.下列微粒中,碳原子都满足最外层为8电子结构的是( )
| A. | 乙基(-CH2CH3) | B. | 碳正离子[(CH3)3C+] | C. | 乙炔 (C2H2) | D. | 羧基 (-COOH) |
18.下列关于元素周期表的叙述正确的是( )
| A. | 元素周期表中有七行,七个周期,有18列,18个族 | |
| B. | 目前使用的元素周期表中,同一主族的元素最外层电子数相同 | |
| C. | 短周期元素是指1~20号元素,其中大多数为非金属 | |
| D. | 元素周期表中,元素的种数与对应的原子种数一样多 |
16.下列离子方程式书写正确的是( )
| A. | 铜和稀硝酸反应 Cu+4H++NO3-=Cu2++2H2O+NO↑ | |
| B. | 碳酸氢钠的水解 HCO3-+H2O?CO32-+H3O+ | |
| C. | Fe投入盐酸中 2Fe+6H+=2Fe3++3H2↑ | |
| D. | 氢氧化铝溶于氢氧化钠溶液 Al(OH)3+OH-=AlO2-+2H2O |
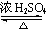 CH3COOCH2CH=CH2+H218O,酯化反应生成的产物在一定条件下可以发生加聚反应得到高分子化合物,其结构简式为
CH3COOCH2CH=CH2+H218O,酯化反应生成的产物在一定条件下可以发生加聚反应得到高分子化合物,其结构简式为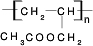 .
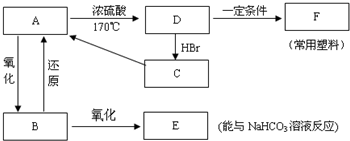
.
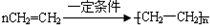 .
.