题目内容
2.常温下,某溶液中由水电离出的c(H+)与c(OH-)的乘积为10-10,该溶液可能是( )| A. | 一定浓度的CH3COONa溶液 | B. | 一定浓度的氨水溶液 | ||
| C. | 一定浓度的NaHSO4溶液 | D. | pH等于5的醋酸溶液 |
分析 常温下,某溶液中由水电离出的c(H+)与c(OH-)的乘积为10-10,c(H+)=c(OH-)=10-5mol/L;水的电离被促进,酸、碱溶液对水的电离起到抑制作用,水解的盐对水的电离起到促进作用.
解答 解:常温下,某溶液中由水电离出的c(H+)与c(OH-)的乘积为10-10,c(H+)=c(OH-)=10-5mol/L,水的电离被促进,
A、一定浓度的CH3COONa溶液中醋酸根离子水解促进水的电离平衡正向进行,水的电离被促进,故A正确;
B、一定浓度的氨水溶液,溶液显碱性,对水的电离起到抑制作用,故B错误;
C、一定浓度的NaHSO4溶液中呈酸性,对水的电离起到抑制作用,故C错误;
D、pH等于5的醋酸溶液中,c(H+)酸=10-5mol/L,对水的电离起到抑制作用,故D错误;
故选A.
点评 本题考查了水电离平衡的影响因素分析判断,注意酸碱抑制水的电离,水解的盐促进水的电离,题目难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
12.下列物质中,溶于水后不能电离出Cl-的是( )
| A. | KClO3 | B. | CaCl2 | C. | HCl | D. | AgCl |
10.下列说法不正确的是( )
| A. | 乙烯、乙炔、乙醛都能使溴水或酸性KMnO4溶液褪色 | |
| B. | 可用加入NaOH溶液并加热,通过观察油层是否消失或变薄来鉴别苯和乙酸乙酯 | |
| C. | 可用H2SO4溶液、银氨溶液和碘水来检验淀粉液是否部分水解 | |
| D. | 油脂在热NaOH溶液中完全水解后,加入饱和食盐水,可观察到液面上有固体析出 |
17.乙醇和乙酸是生活中两种常见的有机物.下列有关说法不正确的是( )
| A. | 乙醇和乙酸都能杀菌消毒 | B. | 乙醇和乙酸都是电解质 | ||
| C. | 乙醇和乙酸都能发生酯化反应 | D. | 乙醇和乙酸都能与活泼金属反应 |
7.下列存放物质的方法中错误的是( )
| A. | Na可保存在CCl4中 | |
| B. | NaOH溶液盛装在带橡皮塞的试剂瓶中 | |
| C. | 用棕色细口试剂瓶存放氯水 | |
| D. | 漂白粉要密闭在容器中保存 |
14.下列离子方程式中书写正确的是( )
| A. | 将Na2O2固体加入水中:Na2O2+2H2O=2Na++2OH-+O2↑ | |
| B. | Ba(OH)2溶液与硫酸的反应:OH-+H+=H2O | |
| C. | Cl2溶于水中:Cl2+H2O=2H++Cl-+ClO- | |
| D. | 少量CO2通入澄清石灰水中:CO2+2OH-+Ca2+═Ca CO3↓+2H2O |
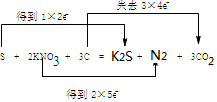 (同时用双线桥表示电子的得失)
(同时用双线桥表示电子的得失)