题目内容
3.已知:氢化钠(NaH)是一种离子化合物,其中钠元素是+1价,NaH跟水反应放出H2.思考并回答下列问题:(1)在氢化钠中存在的化学键为离子键.
(2)在NaH中的氢离子半径比锂离子半径大.(填“大”或“小”)
(3)写出NaH的电子式Na+[:H]-.
(4)写出NaH与水反应的化学方程式NaH+H2O═NaOH+H2↑,在该反应中属于还原剂的是NaH.
分析 (1)NaH是离子化合物,阴离子是H-;
(2)电子排布相同时,原子序数越大,离子半径越小;
(3)NaH是离子化合物,阴离子是H-;
(4)NaH与水反应的方程式为:NaH+H2O═NaOH+H2↑,还原剂是NaH.
解答 解:(1)NaH是离子化合物,阴离子是H-,所以化学键是离子键,故答案为:离子键;
(2)电子排布相同时,原子序数越大,离子半径越小,则微粒半径H->Li+,故答案为:大;
(3)NaH是离子化合物,阴离子是H-,NaH的电子式为Na+[:H]-,故答案为:Na+[:H]-;
(4)NaH与水反应的方程式为:NaH+H2O═NaOH+H2↑,还原剂是NaH,故答案为:NaH+H2O═NaOH+H2↑;NaH.
点评 本题考查了电子式、电子排布、离子半径比较、氧化还原反应等,题目难度不大,侧重于基础知识的考查,注意把握离子半径的比较方法.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
18.下列关于电解质溶液说法正确的是( )
| A. | 用NH3•H2O溶液做导电性实验,灯泡很暗,说明NH3•H2O是弱电解质 | |
| B. | 等体积的pH都为3的酸HA和HB分别与足量的Mg反应,HA放出的H2多,说明酸性:HA>HB | |
| C. | 常温下,弱酸酸式盐NaHA溶液的pH=6,说明HA?的电离程度大于其水解程度 | |
| D. | pH=5的CH3COOH溶液和pH=5的NH4Cl溶液中,水的电离程度相同 |
11.下列说法错误的是( )
| A. | 32 g O2所含的原子数目为NA | |
| B. | 0.5 mol H2O含有的原子数目为1.5NA | |
| C. | NA 个CO和 1 mol N2所含分子数目相等 | |
| D. | 一个钠原子的质量为23/NAg |
18.下列说法没有科学性错误的是( )
| A. | “白雪牌”漂白粉可令所有有色物质黯然失“色”,没有最白,只有更白 | |
| B. | CO有毒,生有煤炉的居室,可放置数盆清水,这样可有效地吸收CO,防止煤气中毒 | |
| C. | 氯化钙具有吸水性和潮解性,夏日里用它的水溶液喷洒柏油路,可有效地保护路面 | |
| D. | 氯元素有毒,禁止放入口中 |
12.下列物质中,溶于水后不能电离出Cl-的是( )
| A. | KClO3 | B. | CaCl2 | C. | HCl | D. | AgCl |
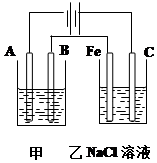 如图为相互串联的甲乙两个电解池,请回答:
如图为相互串联的甲乙两个电解池,请回答: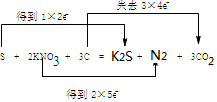 (同时用双线桥表示电子的得失)
(同时用双线桥表示电子的得失)