题目内容
19.下列关于乙烷和乙烯的说法中,不正确的是( )| A. | 乙烷属于饱和链烃,乙烯属于不饱和链烃 | |
| B. | 乙烷分子则为立体结构,不是所有原子都在同一平面上,乙烯分子中所有原子都处于同一平面上 | |
| C. | 乙烷分子存在中的碳碳单键,乙烯分子存在中碳碳双键 | |
| D. | 酸性KMnO4溶液能鉴别乙烷和乙烯,而溴水不能鉴别乙烷和乙烯 |
分析 A.依据碳原子形成的化学键分析,乙烯是不饱和烃,乙烷是饱和烃;
B.根据甲烷是正四面体结构分析乙烷结构,乙烯为平面结构来分析各物质的共面原子;
C.烯烃中存在碳碳双键;
D.把气体通入溴水中,乙烯使其褪色,而乙烷不能,现象不同,可鉴别.
解答 解:A.乙烯含有碳碳双键,属于不饱和烃,乙烷属于饱和烃,故A正确;
B.甲烷是正四面体结构,所以乙烷中所有原子不可能在同一平面上;乙烯为平面结构,所有原子都处在同一平面上,故B正确;
C.烯烃中存在碳碳双键,故C正确;
D.把气体通入溴水中,乙烯使其褪色,而乙烷不能,现象不同,可鉴别,故D正确,故选D.
点评 本题考查了烷烃、烯烃性质的分析应用比较,掌握烷烃、烯烃的结构及性质是解题关键,可以根据甲烷的结构判断乙烷的结构特点,题目较简单.

练习册系列答案
相关题目
9.(1)某实验小组设计了下列实验以探究影响化学反应速率的因素.
实验I:在甲、乙、丙三只相同的试管中分别加入5mL质量分数均为5%的过氧化氢溶液,各加入三滴洗涤剂,再分别放到如图所示的烧杯中水浴加热.实验发现,三支试管中产生气泡的速率不同.(洗涤剂起到将气体变为气泡的作用)

实验Ⅱ:在甲、乙、丙三只相同的试管中分别加入5mL质量分数均为5%的过氧化氢溶液,各加入三滴洗涤剂.在甲试管中加入MnO2少许,在乙试管中加入少许FeCl3,在丙中加入少许新鲜的鸡肝泥.观察到乙试管中产生气泡的速率最慢,而丙试管中产生气泡的速率最快.
实验Ⅲ:在甲、乙、丙三只相同的试管中分别加入5mL质量分数分别为5%,10%和15%的过氧化氢溶液,各加入三滴洗涤剂,再分别滴加三滴浓FeCl3溶液.观察并记录实验现象.
实验Ⅳ:在甲、乙、丙三只相同的试管中分别加入少许鸡肝泥,再分别放到如图所示的烧杯中水浴加热2分钟,再分别向三支试管中加入5mL质量分数均为5%的过氧化氢溶液和三滴洗涤剂.观察到丙中产生气泡速率最慢.

根据上述四个实验,回答下列问题:
①实验I的实验现象是丙中产生气泡速率最快,甲中最慢.
②实验Ⅱ的实验目的是探究MnO2、FeCl3和鸡肝泥三种催化剂对反应速率的影响大小.
③实验Ⅲ的实验目的是探究浓度对反应速率的影响;产生气泡速率最快的是丙试管(填“甲”“乙”或“丙”).
④实验Ⅳ中丙产生气泡速率最慢,该实验现象的原因可能是在80℃时,鸡肝泥失去或降低了催化效率.
(2)在一定温度下,将0.20 mol 的四氧化二氮气体充入1L的固定的密闭容器,每隔一段时间对该容器内的物质进行一次分析,得到如下数据:
根据表格提供数据,请回答下列各小题:
①C1<C2(填<,>或=).
②在0~20S内四氧化二氮的平均反应速度为0.003mol/(L•s).1.
实验I:在甲、乙、丙三只相同的试管中分别加入5mL质量分数均为5%的过氧化氢溶液,各加入三滴洗涤剂,再分别放到如图所示的烧杯中水浴加热.实验发现,三支试管中产生气泡的速率不同.(洗涤剂起到将气体变为气泡的作用)

实验Ⅱ:在甲、乙、丙三只相同的试管中分别加入5mL质量分数均为5%的过氧化氢溶液,各加入三滴洗涤剂.在甲试管中加入MnO2少许,在乙试管中加入少许FeCl3,在丙中加入少许新鲜的鸡肝泥.观察到乙试管中产生气泡的速率最慢,而丙试管中产生气泡的速率最快.
实验Ⅲ:在甲、乙、丙三只相同的试管中分别加入5mL质量分数分别为5%,10%和15%的过氧化氢溶液,各加入三滴洗涤剂,再分别滴加三滴浓FeCl3溶液.观察并记录实验现象.
实验Ⅳ:在甲、乙、丙三只相同的试管中分别加入少许鸡肝泥,再分别放到如图所示的烧杯中水浴加热2分钟,再分别向三支试管中加入5mL质量分数均为5%的过氧化氢溶液和三滴洗涤剂.观察到丙中产生气泡速率最慢.

根据上述四个实验,回答下列问题:
①实验I的实验现象是丙中产生气泡速率最快,甲中最慢.
②实验Ⅱ的实验目的是探究MnO2、FeCl3和鸡肝泥三种催化剂对反应速率的影响大小.
③实验Ⅲ的实验目的是探究浓度对反应速率的影响;产生气泡速率最快的是丙试管(填“甲”“乙”或“丙”).
④实验Ⅳ中丙产生气泡速率最慢,该实验现象的原因可能是在80℃时,鸡肝泥失去或降低了催化效率.
(2)在一定温度下,将0.20 mol 的四氧化二氮气体充入1L的固定的密闭容器,每隔一段时间对该容器内的物质进行一次分析,得到如下数据:
| 时间 (s) 浓度 mol•L-1 | 0 | 20 | 40 | 60 | 80 | 100 |
| C(N2O4) | 0.20 | C1 | 0.10 | C3 | C4 | C5 |
| C(NO2) | 0.00 | 0.12 | C2 | 0.22 | 0.22 | 0.22 |
①C1<C2(填<,>或=).
②在0~20S内四氧化二氮的平均反应速度为0.003mol/(L•s).1.
10.为了鉴定氯乙烷中氯元素的存在,以下各步实验:①加入AgNO3溶液②加入NaOH的醇溶液,③加热 ④用HNO3酸化溶液 ⑤加入NaOH的水溶液其中操作顺序合理的是( )
| A. | ①②③⑤ | B. | ②③④① | C. | ④③⑤① | D. | ⑤③④① |
14.四氯化碳是生产金属钛及其化合物的重要中间体,实验窒利用反应:TiO2(s)+2CCl4(g)$\frac{\underline{\;\;△\;\;}}{\;}$TiCl4(g)+CO2(g),制取TiCl4,实验装置如图所示:
有关物质的性质如下表:
回答下列问题:
(1)仪器m的名称为球形干燥管.
(2)装置A中有氮气生成,该反应的化学方程式为NaNO2+NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$N2↑+NaCl+2H2O
(3)实验装置依次连接的顺序为A→F→B→C→E→D.装置F中盛有的物质是浓硫酸(4)装置D的作用是防止外界的水汽进入TiCl4收集装置里.
(5)欲分离装置E中的液态混合物,所采用操作的名称是蒸馏.
(6)反应结束前进行如下操作:①停止通氮气②熄灭酒精灯③冷却至室温,正确的操作顺序是②③①(填序号)
(7)利用反应:TiO2(s)+2C(s)+2Cl2(g)$\frac{\underline{\;\;△\;\;}}{\;}$TiCl4(g)+2CO(g),也可以制取TiCl4,除了在上述实验装置中将装置A改为氯气的发生装置,撤去装置B之外,请简述对其他装置的改变:石英管内改为盛TiO2和C;增加CO的吸收装置;.

有关物质的性质如下表:
| 物质 | 熔点/℃ | 沸点/℃ | 其它 |
| CCl4 | -23 | 76 | 与 TiCl4互溶 |
| TiCl4 | -25 | 136 | 遇潮湿空气产生白雾,加热时能被氧气氧化 |
(1)仪器m的名称为球形干燥管.
(2)装置A中有氮气生成,该反应的化学方程式为NaNO2+NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$N2↑+NaCl+2H2O
(3)实验装置依次连接的顺序为A→F→B→C→E→D.装置F中盛有的物质是浓硫酸(4)装置D的作用是防止外界的水汽进入TiCl4收集装置里.
(5)欲分离装置E中的液态混合物,所采用操作的名称是蒸馏.
(6)反应结束前进行如下操作:①停止通氮气②熄灭酒精灯③冷却至室温,正确的操作顺序是②③①(填序号)
(7)利用反应:TiO2(s)+2C(s)+2Cl2(g)$\frac{\underline{\;\;△\;\;}}{\;}$TiCl4(g)+2CO(g),也可以制取TiCl4,除了在上述实验装置中将装置A改为氯气的发生装置,撤去装置B之外,请简述对其他装置的改变:石英管内改为盛TiO2和C;增加CO的吸收装置;.
11.按以下实验方案可以从海洋动物柄海鞘中提取具有抗肿瘤活性的天然产物.

下列说法错误的是( )

下列说法错误的是( )
| A. | 步骤①需要使用普通漏斗 | B. | 步骤②要使用分液漏斗 | ||
| C. | 步骤③要用到坩埚 | D. | 步骤④需要蒸馏装置 |
 制取
制取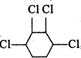 ,即
,即
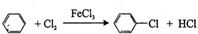 ;⑤
;⑤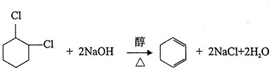 ;⑥
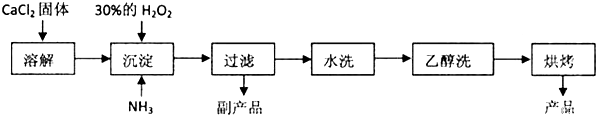
;⑥ .
.
 FeCl3溶液可用作印刷电路铜板的腐蚀剂,该腐蚀过程的离子方程式为2Fe3++Cu=2Fe2++Cu2+.若将该反应设计成原电池,请在如图方框中画出原电池的装置简图,标出正、负极及两极材料和电解质溶液.
FeCl3溶液可用作印刷电路铜板的腐蚀剂,该腐蚀过程的离子方程式为2Fe3++Cu=2Fe2++Cu2+.若将该反应设计成原电池,请在如图方框中画出原电池的装置简图,标出正、负极及两极材料和电解质溶液.