题目内容
9. FeCl3溶液可用作印刷电路铜板的腐蚀剂,该腐蚀过程的离子方程式为2Fe3++Cu=2Fe2++Cu2+.若将该反应设计成原电池,请在如图方框中画出原电池的装置简图,标出正、负极及两极材料和电解质溶液.
FeCl3溶液可用作印刷电路铜板的腐蚀剂,该腐蚀过程的离子方程式为2Fe3++Cu=2Fe2++Cu2+.若将该反应设计成原电池,请在如图方框中画出原电池的装置简图,标出正、负极及两极材料和电解质溶液.
分析 Fe3+有强氧化性,能把金属铜氧化成铜离子;根据电池反应式设计原电池,由发生反应的反应类型设计正负极,将发生氧化反应的金属单质设计成负极,比负极不活泼的金属或导电的非金属设计成正极,反应物中的电解质设计为电解质溶液.
解答 解:Fe3+有强氧化性,能把金属铜氧化成铜离子,自身被还原成 Fe2+,反应方程式为2Fe3++Cu=2Fe2++Cu2+;设计成原电池时,负极上发生氧化反应,正极上发生还原反应,该电池反应中三价铁离子得电子发生还原反应,所以正极上的电极反应式为Fe3++e-=Fe2+(或2Fe3++2e-=2Fe2+),铜失电子发生氧化反应,所以负极上的电极反应式为Cu=2Cu2++2e-(或Cu-2e-=Cu2+);电池反应中发生氧化反应的金属作负极,所以铜作负极,不如负极活泼的金属或导电的非金属作正极,可选石墨作正极,发生还原反应的电解质溶液作原电池的电解质溶液,所以该原电池图为 ,
,
故答案为:故答案为:2Fe3++Cu=2Fe2++Cu2+; .
.
点评 本题考查学生原电池的构成条件、工作原理以及燃料电池的工作原理知识,注重基础知识的考查,难度不大.

练习册系列答案
相关题目
19.下列关于乙烷和乙烯的说法中,不正确的是( )
| A. | 乙烷属于饱和链烃,乙烯属于不饱和链烃 | |
| B. | 乙烷分子则为立体结构,不是所有原子都在同一平面上,乙烯分子中所有原子都处于同一平面上 | |
| C. | 乙烷分子存在中的碳碳单键,乙烯分子存在中碳碳双键 | |
| D. | 酸性KMnO4溶液能鉴别乙烷和乙烯,而溴水不能鉴别乙烷和乙烯 |
20.鉴定氯乙烷中含有氯元素有下列操作:①加入AgNO3溶液 ②加热 ③用硝酸酸化 ④加蒸馏水 ⑤用盐酸酸化 ⑥加氢氧化钠溶液.其中正确的操作顺序是( )
| A. | ①⑤②③ | B. | ⑥②③① | C. | ⑤⑥③② | D. | ⑥②⑤① |
4.下列各组中,每种电解质溶液电解时只生成氢气和氧气的是( )
| A. | NaOH、H2SO4 | B. | NaOH、CuSO4 | C. | HCl、CuCl2 | D. | NaCl、AgNO3 |
14.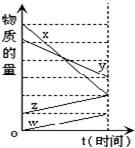 如图表示在某温度下经时间t反应后,物质x、y、z、w的物质的量的变化情况.则所发生反应的化学方程式是( )
如图表示在某温度下经时间t反应后,物质x、y、z、w的物质的量的变化情况.则所发生反应的化学方程式是( )
 如图表示在某温度下经时间t反应后,物质x、y、z、w的物质的量的变化情况.则所发生反应的化学方程式是( )
如图表示在某温度下经时间t反应后,物质x、y、z、w的物质的量的变化情况.则所发生反应的化学方程式是( )| A. | 4x+2y=z+w | B. | 6x+5y=4z+w | C. | 3w+z=4x+2y | D. | 2x+y=2z+2w |
1.室温下,下列各组微粒在指定的分散系中一定能大量共存的是( )
| A. | pH=13的溶液:Na+、Ba2+、NH3、Cl- | |
| B. | 由水电离的c(H+)=1×10-14mol•L-1的溶液:K+、Ca2+、Cl-、HCO3- | |
| C. | Al(OH)3胶体:Na+、K+、Cl-、SO42- | |
| D. | 使甲基橙呈红色的溶液:Na+、Fe2+、SO42-、NO3- |
19.据《华盛顿邮报》报道,美国食品与药物管理局2010年2月公布了一份草拟的评估报告,指出塑料奶瓶和婴儿奶粉罐普遍存在的化学物质双酚A,并不会对婴儿或成人的健康构成威胁.关于双酚A的下列说法相对正确的是( )

| A. | 该化合物属于芳香烃 | |
| B. | 该化合物分子式为C20H24O2 | |
| C. | 1mol双酚A最多消耗4molBr2 | |
| D. | 双酚A能使溴水褪色,但不能使酸性高锰酸钾溶液褪色 |