题目内容
19. 已知醋酸和盐酸是日常生活中极为常见的酸,在一定条件下,CH3COOH溶液中存在电离平衡:CH3COOH?CH3COO-+H+△H>0.
已知醋酸和盐酸是日常生活中极为常见的酸,在一定条件下,CH3COOH溶液中存在电离平衡:CH3COOH?CH3COO-+H+△H>0.(1)25℃时,浓度均为0.1mol/L的盐酸和醋酸溶液,下列说法正确的是④;
①两溶液的pH相同
②两溶液的导电能力相同
③由水电离出的c(OH-)相同
④中和等物质的量的NaOH溶液,消耗两溶液的体积相同
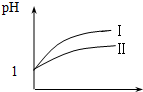
(2)25℃时,向pH均为1的盐酸和醋酸溶液中分别加水,随加水量的增多,两溶液pH的变化如图所示,则符合盐酸pH变化的曲线是I;
(3)25℃时,向体积为Va mLpH=3的醋酸溶液中滴加pH=11的NaOH溶液Vb mL至溶液恰好呈中性,则Va与的Vb关系是加水量Va<Vb(填“>”、“<”或“=”).
(4)25℃时,若向氨水中加入稀盐酸至溶液的pH=7,此时[NH4+]=a mol/L,则[Cl-]=amol/L.
分析 (1)①CH3COOH是弱电解质,HCl是强电解质,等浓度的两种溶液中盐酸中c(H+)大于CH3COOH;
②溶液的导电能力与离子浓度成正比;
③酸抑制水电离,酸中氢离子浓度越大,其抑制程度越大;
④中和等物质的量的NaOH溶液,消耗酸的体积与酸的浓度成反比;
(2)pH相等的醋酸和盐酸中,加水稀释促进醋酸电离,导致稀释相同的倍数时,醋酸的pH小于HCl;
(3)混合溶液呈中性,则c(H+)=c(OH-),醋酸钠是强碱弱酸盐,其溶液呈碱性,要使混合溶液呈中性,则醋酸应该稍微过量;
(4)25℃时,若向氨水中加入稀盐酸至溶液的pH=7,溶液呈中性说明氢离子和氢氧根的浓度一定相等,根据电荷守恒来计算离子浓度.
解答 解:(1)①CH3COOH是弱电解质,HCl是强电解质,等浓度的两种溶液中盐酸中c(H+)大于CH3COOH,所以醋酸的pH大于HCl,故错误;
②CH3COOH是弱电解质,HCl是强电解质,等浓度的两种溶液中盐酸中离子浓度大于醋酸,溶液的导电能力与离子浓度成正比,所以HCl溶液的导电能力强,故错误;
③酸抑制水电离,酸中氢离子浓度越大,其抑制程度越大,等浓度的两种酸中,HCl中氢离子浓度大于醋酸,所以由水电离出的c(OH-)醋酸大于盐酸,故错误;
④中和等物质的量的NaOH溶液,消耗酸的体积与酸的浓度成反比,两种酸的物质的量浓度相等,所以需要酸的体积相等,故正确;
故答案为:④;
(2)pH相等的醋酸和盐酸中,加水稀释促进醋酸电离,导致稀释相同的倍数时,醋酸的pH小于HCl,根据图象知,I是HCl变化曲线;
故答案为:I;
(3)醋酸溶液是弱酸,pH为3的醋酸溶液中,醋酸的浓度大于10-3mol/L,pH=11的NaOH溶液浓度等于10-3mol/L,最后溶液恰好呈中性,说明碱多,所以Va<Vb,
故答案为:<;
(4)混合溶液呈中性,则c(H+)=c(OH-),再根据电荷守恒得到c(NH4+)+c(H+)=c(OH-)+c(Cl-),即c(Cl-)=c(NH4+)=amol/L.
故答案为:amol/L.
点评 本题考查了弱电解质的电离,题目难度中等,根据电解质电离特点结合盐类水解等知识点来分析解答,注意溶液的导电性与离子浓度有关,与电解质强弱无关,为易错点.

| A. | BaCl2有两性 | |
| B. | 两试管沉淀均是BaSO3 | |
| C. | SO2有还原性,酸性 | |
| D. | 升高PH,使SO2水溶液中SO32-浓度增大 |
| A. | 用过量NaOH溶液除去镁粉中的铝粉 | B. | AlCl3溶液和氨水制备Al(OH)3沉淀 | ||
| C. | 用盐酸和AgNO3溶液鉴定Cl- | D. | 用加热的方法鉴别Na2CO3和NaHCO3 |
| A. | 6.8 g熔融KHSO4 与3.9 g熔融Na2O2 中阴离子数目相同 | |
| B. | 某金属阳离子的结构示意图为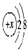 ,其与Cl-形成的强电解质都是离子化合物 ,其与Cl-形成的强电解质都是离子化合物 | |
| C. | 二硫化碳与二氧化碳结构相似,其电子式为 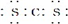 | |
| D. | 中子数为18的氯原子可表示为18Cl |
| A. | 16g O2一定条件下与一定量的钠反应转移的电子数一定为2NA | |
| B. | 14 g乙烯和丙烯的混合气体中总原子数为3NA | |
| C. | 1L1 mol/L饱和FeCl3溶液滴入沸水中完全水解生成NA个氢氧化铁胶体粒子 | |
| D. | 0.1 mol•L-1 氢氧化钠溶液中所含钠离子数为0.1NA |
| A. | 利用太阳能等清洁能源代替化石燃料,有利于节约资源、保护环境 | |
| B. | 金属材料都是导体,非金属材料都是绝缘体 | |
| C. | 为防止电池中的重金属等污染土壤和水体,应积极开发废电池的综合利用技术 | |
| D. | 我国规定自2008年6月1日起,商家不得无偿提供塑料袋,目的是减少“白色污染” |
| A. | CH≡CH | B. | CH3CH3 | C. | CH3CH2OH | D. | CH3OCH3 |
| A. | E 元素处于元素周期表中第3 周期第ⅦA 族 | |
| B. | 元素A、B、C 的原子半径:C>B>A | |
| C. | 元素B、C、D 的非金属性:C>B>D | |
| D. | 一定条件下,A 单质可以将D 单质从其氧化物中置换出来 |