题目内容
9.下列鉴别碳酸钠和碳酸氢钠固体的方法中错误的是( )| A. | 分别取两种固体样品,加热产生气体的是碳酸氢钠 | |
| B. | 分别取样溶于水后加入氯化钙溶液,若有白色沉淀则是碳酸钠 | |
| C. | 分别取样溶于水后加入澄清石灰水,若有白色沉淀则是碳酸钠 | |
| D. | 分别取等质量的两种固体样品,与足量的硫酸反应,产生气体较多的是碳酸氢钠 |
分析 A.碳酸氢钠加热分解,而碳酸钠不能;
B.碳酸钠与氯化钙反应生成白色沉淀,而碳酸氢钠不反应;
C.二者均与石灰水反应生成白色沉淀;
D.等质量时碳酸氢钠的物质的量大,与硫酸反应生成二氧化碳多.
解答 解:A.碳酸氢钠加热分解生成气体,而碳酸钠不能,则加热可鉴别,故A正确;
B.碳酸钠与氯化钙反应生成白色沉淀,而碳酸氢钠不反应,则有白色沉淀则是碳酸钠,可鉴别,故B正确;
C.二者均与石灰水反应生成白色沉淀,现象相同,不能鉴别,故C错误;
D.由n=$\frac{m}{M}$可知,等质量时碳酸氢钠的物质的量大,由C原子守恒可知,碳酸氢钠与硫酸反应生成二氧化碳多,可鉴别,故D正确;
故选C.
点评 本题考查物质的鉴别,为高频考点,把握物质的性质、发生的反应和现象为解答的关键,侧重分析与实验能力的考查,注意元素化合物知识与实验的结合,题目难度不大.

练习册系列答案
 暑假作业安徽少年儿童出版社系列答案
暑假作业安徽少年儿童出版社系列答案
相关题目
4.制取水处理剂C1O2(其部分性质如下表所示)的方法之一是利用草酸(H2C2O4)与氯酸钾反应,反应的化学方程式为2KC1O3+aH2C2O4+H2SO4=2C1O2↑+K2SO4+2CO2↑+bH2O.下列有关该反应的说法不正确的是( )
| 熔点/℃ | 沸点/℃ | 水溶性 |
| -59.5 | 11.0 | 极易溶解 |
| A. | 化学方程式中的a=l,b=2 | |
| B. | 草酸起到还原剂的作用 | |
| C. | KC1O3中只有Cl元素被还原 | |
| D. | 在标准状况下生成5.6L C1O2,转移0.2mol电子 |
5.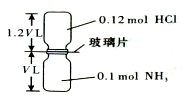 已知反应:HCl+NH3=NH4Cl(固体)如图所示,抽去装置中的玻璃片,使两种气体充分反应(整个过程中认为装置气密性良好),等温度恢复到原来温度.下列说法正确的是( )
已知反应:HCl+NH3=NH4Cl(固体)如图所示,抽去装置中的玻璃片,使两种气体充分反应(整个过程中认为装置气密性良好),等温度恢复到原来温度.下列说法正确的是( )
 已知反应:HCl+NH3=NH4Cl(固体)如图所示,抽去装置中的玻璃片,使两种气体充分反应(整个过程中认为装置气密性良好),等温度恢复到原来温度.下列说法正确的是( )
已知反应:HCl+NH3=NH4Cl(固体)如图所示,抽去装置中的玻璃片,使两种气体充分反应(整个过程中认为装置气密性良好),等温度恢复到原来温度.下列说法正确的是( )| A. | 反应后瓶内压强是反应前的$\frac{1}{10}$ | |
| B. | 装置中氢元素的总质量为0.42 g | |
| C. | 生成物的分子数目为0.1 NA | |
| D. | 反应结束后,两个集气瓶很容易分开 |
17.某温度时,发生反应2HI (g)?H2 (g)+I2 (g),向三个体积相等的恒容密闭容器A、B、C中,分别加入①2mol HI;②3mol HI;③1mol H2与1mo1I2,分别达平衡时,以下关系正确的是( )
| A. | 平衡时,各容器的压强:②=①=③ | B. | 平衡时,I2的浓度:②>①=③ | ||
| C. | 平衡时,I2的体积分数:②=①=③ | D. | 从反应开始到达平衡的时间:①>②=③ |
4.常温下pH=3的CH3COOH溶液,下列叙述不正确的是( )
| A. | 与等体积pH=11的NaOH溶液混合后所得溶液显酸性 | |
| B. | c(H+)=c(CH3COO-)+c(OH-) | |
| C. | 该溶液中由水电离出的c(H+)是1.0×10-11 mol/L | |
| D. | 加入少量CH3COONa固体后,c(CH3COO-)降低 |
14.粗盐提纯使用的主要仪器有( )
| A. | 漏斗、烧杯、蒸发皿、酒精灯 | B. | 量筒、烧杯、试管夹、蒸发皿 | ||
| C. | 玻璃棒、蒸发皿、漏斗、集气瓶 | D. | 铁架台、天平、长颈漏斗、酒精灯 |
1.作为新型燃料,氢气具有的突出优点是( )
| A. | 在自然界里存在氢气 | B. | 燃烧氢气污染小 | ||
| C. | 氢气轻,便于携带 | D. | 氢气燃烧发热量高 |
18.不能实现下列物质间直接转化的元素是( )
单质$\stackrel{+O_{2}}{→}$氧化物$\stackrel{+H_{2}O}{→}$酸或碱$\stackrel{+NaOH或HCl}{→}$盐.
单质$\stackrel{+O_{2}}{→}$氧化物$\stackrel{+H_{2}O}{→}$酸或碱$\stackrel{+NaOH或HCl}{→}$盐.
| A. | 碳 | B. | 钠 | C. | 硫 | D. | 铁 |
19.某浓度的氨水中存在下列平衡:NH3•H2O?NH4++OH-,如想增大NH4+的浓度,而不增大OH-的浓度,应采取的措施是( )
| A. | 适当升高温度 | B. | 加入NH4Cl固体 | C. | 通入NH3 | D. | 加水稀释 |