题目内容
实验室需要配制230mL 1mol?L-1的NaOH溶液,现用氢氧化钠固体配制,有以下仪器:①烧杯 ②100mL量筒 ③500mL容量瓶 ④250mL容量瓶 ⑤玻璃棒 ⑥托盘天平;
其实验步骤为:①计算;②称量;③洗涤,振荡;④溶解,冷却;⑤摇匀;⑥定容;⑦转移.
根据上述信息回答问题:
(1)配制时,必须使用的仪器有 (填代号),还缺少的仪器是 .
(2)本实验操作步骤的正确顺序为 .
(3)实验两次用到玻璃棒,其作用分别是: 、 .
(4)本实验中需要称量的氢氧化钠固体的质量为 g
(5)如果实验遇到下列情况,对该氢氧化钠的物质的量浓度有何影响(填“偏高”、“偏低”或者“不变”)
①溶解氢氧化钠固体的烧杯没有洗涤 .
②搅拌以加速溶解时不小心洒出一小滴溶液 .
③未冷却至室温就注入定容 .
其实验步骤为:①计算;②称量;③洗涤,振荡;④溶解,冷却;⑤摇匀;⑥定容;⑦转移.
根据上述信息回答问题:
(1)配制时,必须使用的仪器有
(2)本实验操作步骤的正确顺序为
(3)实验两次用到玻璃棒,其作用分别是:
(4)本实验中需要称量的氢氧化钠固体的质量为
(5)如果实验遇到下列情况,对该氢氧化钠的物质的量浓度有何影响(填“偏高”、“偏低”或者“不变”)
①溶解氢氧化钠固体的烧杯没有洗涤
②搅拌以加速溶解时不小心洒出一小滴溶液
③未冷却至室温就注入定容
考点:配制一定物质的量浓度的溶液
专题:
分析:(1)根据实验操作步骤确定每步操作需要仪器,然后判断还缺少仪器名称;
(2)据配制溶液的实验操作过程进行实验步骤排序;
(3)根据配制步骤判断玻璃棒的作用;
(4)根据n=cV计算出=氢氧化钠的物质的量,再根据m=nM计算出溶质氢氧化钠的质量;
(5)根据c=
可得,一定物质的量浓度溶液配制的误差都是由溶质的物质的量n和溶液的体积V引起的,误差分析时,关键要看配制过程中引起n和V怎样的变化:若n比理论值小,或V比理论值大时,都会使所配溶液浓度偏小;若n比理论值大,或V比理论值小时,都会使所配溶液浓度偏大.
(2)据配制溶液的实验操作过程进行实验步骤排序;
(3)根据配制步骤判断玻璃棒的作用;
(4)根据n=cV计算出=氢氧化钠的物质的量,再根据m=nM计算出溶质氢氧化钠的质量;
(5)根据c=
| n |
| V |
解答:
解:(1)没有230mL容量瓶,需要配制1mol?L-1的NaOH溶液250mL,配制步骤有称量、溶解、移液、洗涤移液、定容、摇匀等操作,用天平称量NaOH(用到药匙),在烧杯中稀释,并用玻璃棒搅拌,加速溶解,冷却后转移到250mL容量瓶中,并用玻璃棒引流,洗涤2-3次,并将洗涤液移入容量瓶,当加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,最后定容颠倒摇匀.
所以给出的仪器必须使用的仪器有①④⑤⑥;还需要药匙、胶头滴管,
故答案为:①④⑤⑥;药匙、胶头滴管;
(2)配制1mol?L-1的NaOH溶液250mL,配制步骤有计算、称量、溶解、移液、洗涤移液、定容、摇匀等操作,用天平称量NaOH(用到药匙),在烧杯中稀释,并用玻璃棒搅拌,加速溶解,冷却后转移到250mL容量瓶中,并用玻璃棒引流,洗涤2-3次,并将洗涤液移入容量瓶,当加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,最后定容颠倒摇匀,
所以操作顺序为:①②④⑦③⑥⑤,
故答案为:①②④⑦③⑥⑤;
(3实验中两次用到玻璃棒,溶解氢氧化钠溶液时需要使用玻璃棒搅拌、转移溶液时用玻璃棒引流,
故答案为:搅拌;引流;
(4)250mL 1mol?L-1的NaOH溶液中含有氢氧化钠的物质的量为:1mol/L×0.25L=0.25mol,需要氢氧化钠的质量为:40g/mol×0.25mol=10.0g,
故答案为:10.0;
(5)A.溶解氢氧化钠固体的烧杯没有洗涤,导致氢氧化钠的质量偏小,配制的溶液浓度偏低,故答案为:偏低;
B.搅拌以加速溶解时不小心洒出一小滴溶液,导致配制的溶液中溶质氢氧化钠的物质的量偏小,配制的溶液浓度偏低,故答案为:偏低;
C.未经冷却趁热将溶液注入容量瓶中定容,待冷却后溶液体积偏小,浓度偏高,故答案为:偏高.
所以给出的仪器必须使用的仪器有①④⑤⑥;还需要药匙、胶头滴管,
故答案为:①④⑤⑥;药匙、胶头滴管;
(2)配制1mol?L-1的NaOH溶液250mL,配制步骤有计算、称量、溶解、移液、洗涤移液、定容、摇匀等操作,用天平称量NaOH(用到药匙),在烧杯中稀释,并用玻璃棒搅拌,加速溶解,冷却后转移到250mL容量瓶中,并用玻璃棒引流,洗涤2-3次,并将洗涤液移入容量瓶,当加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,最后定容颠倒摇匀,
所以操作顺序为:①②④⑦③⑥⑤,
故答案为:①②④⑦③⑥⑤;
(3实验中两次用到玻璃棒,溶解氢氧化钠溶液时需要使用玻璃棒搅拌、转移溶液时用玻璃棒引流,
故答案为:搅拌;引流;
(4)250mL 1mol?L-1的NaOH溶液中含有氢氧化钠的物质的量为:1mol/L×0.25L=0.25mol,需要氢氧化钠的质量为:40g/mol×0.25mol=10.0g,
故答案为:10.0;
(5)A.溶解氢氧化钠固体的烧杯没有洗涤,导致氢氧化钠的质量偏小,配制的溶液浓度偏低,故答案为:偏低;
B.搅拌以加速溶解时不小心洒出一小滴溶液,导致配制的溶液中溶质氢氧化钠的物质的量偏小,配制的溶液浓度偏低,故答案为:偏低;
C.未经冷却趁热将溶液注入容量瓶中定容,待冷却后溶液体积偏小,浓度偏高,故答案为:偏高.
点评:本题考查了配制一定物质的量浓度的溶液方法,题目难度不大,注意掌握配制一定浓度的溶液方法,能够根据配制步骤选用仪器,并明确玻璃棒在配制过程中的作用.该题的难点在于误差分析,注意明确误差分析的方法.

练习册系列答案
相关题目
在MgCl2、KCl、K2SO的混合溶液中,若K+为0.8mol,Cl-为1.3mol,Mg2+为0.5mol,则SO42-的物质的量为( )
| A、0.1mol |
| B、0.5mol |
| C、0.15mol |
| D、0.25mol |
符合如图中阴影部分的物质是( )


| A、Na2CO3 |
| B、Cu2(OH)2CO3 |
| C、NaCl |
| D、NaHSO4 |
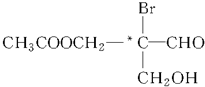 下列有机物分子中带“*”碳原子就是手性碳原子.该有机物分别发生下列反应,生成的有机物分子中含有手性碳原子的是( )
下列有机物分子中带“*”碳原子就是手性碳原子.该有机物分别发生下列反应,生成的有机物分子中含有手性碳原子的是( )| A、与乙酸发生酯化反应 |
| B、在稀硫酸作用下水解 |
| C、与银氨溶液作用发生银镜反应 |
| D、催化剂作用下与H2反应 |
下列离子方程式书写正确的是 ( )
| A、银氨溶液中加入足量盐酸产生沉淀[Ag(NH3)2]-+OH-+3H++Cl-═AgCl↓+2NH4++H2O |
| B、在亚硫酸钡沉淀中加入稀硝酸后,沉淀不溶解3BaSO3+2H++2NO3-═3BaSO4↓+2NO↑+H2O |
| C、孔雀石可溶于盐酸 CO32-+2H+═CO2↑+H2O |
| D、氧化铁可溶于氢碘酸 Fe2O3+6H+═2Fe3++3H2O |
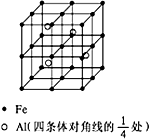 第四周期过渡元素Fe、Ti可与C、H、N、O形成多种化合物.
第四周期过渡元素Fe、Ti可与C、H、N、O形成多种化合物.
 结构,苯环上含有两个取代基,且在核磁共振氢谱中只出现4种峰的所有物质的结构简式为:
结构,苯环上含有两个取代基,且在核磁共振氢谱中只出现4种峰的所有物质的结构简式为: