题目内容
能正确表示下列反应的离子方程式为( )
| A、用浓盐酸酸化的KMnO4溶液与H2O2反应,证明H2O2具有还原性:2MnO4-+6H++5H2O2=2Mn2++5O2↑+8H2O |
| B、大理石溶于醋酸中:CaCO3+2CH3COOH=Ca2++2CH3COO-+CO2↑+H2O |
| C、Mg(HCO3)2溶液与过量NaOH:Mg2++2HCO3-+2OH-=MgCO3↓+2H2O+CO32- |
| D、次氯酸钙与亚硫酸:Ca2++2ClO-+H2SO3=CaSO3↓+2HClO |
考点:离子方程式的书写
专题:离子反应专题
分析:A.浓盐酸和双氧水都能被高锰酸钾氧化;
B.二者反应生成醋酸钙、二氧化碳和水;
C.二者反应生成氢氧化镁、碳酸钠和水;
D.二者反应生成硫酸钙和盐酸.
B.二者反应生成醋酸钙、二氧化碳和水;
C.二者反应生成氢氧化镁、碳酸钠和水;
D.二者反应生成硫酸钙和盐酸.
解答:
解:A.浓盐酸和双氧水都能被高锰酸钾氧化,浓盐酸和双氧水都能使酸性高锰酸钾溶液褪色,所以不能判断双氧水的还原性,要证明双氧水的还原性,高锰酸钾溶液中应该滴加稀硫酸,故A错误;
B.二者反应生成醋酸钙、二氧化碳和水,离子方程式为CaCO3+2CH3COOH=Ca2++2CH3COO-+CO2↑+H2O,故B正确;
C.二者反应生成氢氧化镁、碳酸钠和水,离子方程式为Mg2++2HCO3-+4OH-=Mg(OH)2↓+2H2O+2CO32-,故C错误;
D.二者反应生成硫酸钙和盐酸,离子方程式为SO2+H2O+Ca2++ClO-=CaSO4↓+Cl-+2H+,故D错误;
故选B.
B.二者反应生成醋酸钙、二氧化碳和水,离子方程式为CaCO3+2CH3COOH=Ca2++2CH3COO-+CO2↑+H2O,故B正确;
C.二者反应生成氢氧化镁、碳酸钠和水,离子方程式为Mg2++2HCO3-+4OH-=Mg(OH)2↓+2H2O+2CO32-,故C错误;
D.二者反应生成硫酸钙和盐酸,离子方程式为SO2+H2O+Ca2++ClO-=CaSO4↓+Cl-+2H+,故D错误;
故选B.
点评:本题考查离子方程式正误判断,明确物质的性质及离子方程式书写规则即可解答,注意弱电解质、气体、沉淀、单质、氧化物等写化学式,易错选项是CD,注意C中氢氧化镁和碳酸镁溶度积大小、D中二者发生氧化还原反应,为易错点.

练习册系列答案
相关题目
已知1-18号元素的离子aW3+、bX+、cY2-、dZ-都具有相同的电子层结构,下列关系正确的是( )
| A、质子数:a>c>b>d |
| B、离子的还原性:Y2->Z- |
| C、离子半径:Y2->Z->X+>W3+ |
| D、元素电负性大小顺序:Y>Z |
某化合物6.4g在O2中完全燃烧,只生成8.8g CO2和7.2g H2O.下列说法正确的是( )
| A、该化合物仅含碳、氢两种元素 |
| B、该化合物中碳、氢原子个数比为1:2 |
| C、无法确定该化合物是否含有氧元素 |
| D、该化合物中一定含有氧元素 |
测得VLAl2(SO4)3溶液中含Al3+mg,则该溶液中SO42-的物质的量浓度是( )
A、
| ||
B、
| ||
C、
| ||
D、
|
下列离子方程式正确的是( )
| A、向BaCl2溶液中通入SO2气体:Ba2++SO2+H2O=BaSO3↓+2H+ |
| B、FeBr2与Cl2物质的量1:1在溶液中反应:2Fe2++Cl2=2Fe3++2Cl- |
| C、向碳酸钠溶液中加入足量硫酸铝溶液:Al3++3CO32-+3H2O=Al(OH)3↓+3HCO3- |
| D、将等物质的量浓度、等体积的Ba(OH)2溶液和NaHSO4溶液混合:Ba2++SO42-+H++OH-=BaSO4↓+H2O |
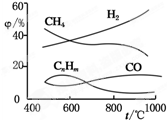 我国正在兴起新能源汽车,其中以甲烷为燃料的汽车,能有效降低碳的排放、降低污染.如图为密闭加热某地煤样所得煤气组成及体积分数随温度变化的曲线图.由图可知( )
我国正在兴起新能源汽车,其中以甲烷为燃料的汽车,能有效降低碳的排放、降低污染.如图为密闭加热某地煤样所得煤气组成及体积分数随温度变化的曲线图.由图可知( )| A、煤只含有碳、氢、氧三种元素 |
| B、煤中所含的有机物是CH4、CnHm、CO |
| C、温度在580~600℃范围内,CH4、CnHm分解不会生成CO |
| D、800℃以后CnHm分解生成了甲烷和氢气 |
 碱金属元素在科学研究与生产生活中有着非常广泛的用途.
碱金属元素在科学研究与生产生活中有着非常广泛的用途.