题目内容
将等物质的量的A、B混合于2L的密闭容器中,发生如下反应:
3A(g)+B(g)?xC(g)+2D(g),经5min后,测得D的浓度为0.5mol/L,c(A):c(B)=3:5,C的平均反应速率为0.1mol/(L?min).求:
(1)此时A的浓度c(A)= mol/L,反应开始前容器中的A、B的物质的量:n(A)=n(B)= mol;
(2)前5min内用B表示的平均反应速率v(B)= mol/(L?min);
(3)化学反应方程式中x的值为 .
(4)5min时物质A的转化率为 .
3A(g)+B(g)?xC(g)+2D(g),经5min后,测得D的浓度为0.5mol/L,c(A):c(B)=3:5,C的平均反应速率为0.1mol/(L?min).求:
(1)此时A的浓度c(A)=
(2)前5min内用B表示的平均反应速率v(B)=
(3)化学反应方程式中x的值为
(4)5min时物质A的转化率为
考点:化学平衡的计算
专题:化学平衡专题
分析:(1)根据D的浓度求出D的物质的量,结合方程式求出A、B的物质的量;
(2)先求出反应的B的物质的量,再根据平均反应速率公式计算B的平均反应速率;
(3)根据同一反应中反应速率之比等于化学计量数之比求出x值;
(4)5min时物质A的转化率为
×100%.
(2)先求出反应的B的物质的量,再根据平均反应速率公式计算B的平均反应速率;
(3)根据同一反应中反应速率之比等于化学计量数之比求出x值;
(4)5min时物质A的转化率为
| A的变化 量 |
| A的起始量 |
解答:
解:(1)5分钟后,n(D)=CV=0.5mol/L×2L=1mol,设反应开始前放入容器中A、B物质的量为mmol,
3A(g)+B(g)?xC(g)+2D(g),
反应前 m mol m mol 0 0
5分钟后( m-1.5)mol ( m-0.5)mol 1mol
c(A):c(B)=3:5=( m-1.5)mol:( m-0.5)mol
m=3 mol
此时A的浓度c(A)=
=0.75mol/L,
故答案为:0.75;3;
(2)设反应的B的物质的量为nmol,
3A(g)+B(g)?xC(g)+2D(g),
1 2
nmol 1mol
n=0.5
根据v(B)=
=0.05 mol/(L.min)
故答案为:0.05;
(3)根据同一反应中反应速率之比等于化学计量数之比,所以v(B):v(C)=0.05 mol/(L.min):0.1mol/(L?min)=1:x,所以x=2,故答案为:2;
(4)5min时物质A的转化率为
×100%=
=50%,故答案为:50%.
3A(g)+B(g)?xC(g)+2D(g),
反应前 m mol m mol 0 0
5分钟后( m-1.5)mol ( m-0.5)mol 1mol
c(A):c(B)=3:5=( m-1.5)mol:( m-0.5)mol
m=3 mol
此时A的浓度c(A)=
| (3-1.5)mol |
| 2L |
故答案为:0.75;3;
(2)设反应的B的物质的量为nmol,
3A(g)+B(g)?xC(g)+2D(g),
1 2
nmol 1mol
n=0.5
根据v(B)=
| △n |
| V×△t |
故答案为:0.05;
(3)根据同一反应中反应速率之比等于化学计量数之比,所以v(B):v(C)=0.05 mol/(L.min):0.1mol/(L?min)=1:x,所以x=2,故答案为:2;
(4)5min时物质A的转化率为
| A的变化 量 |
| A的起始量 |
| 1.5 |
| 3 |
点评:本题考查了化学反应速率与化学计量数的关系,明确同一反应中反应速率之比等于化学计量数之比是解(3)的关键.

练习册系列答案
相关题目
在下列溶液中Cl-离子的物质的量浓度最大的是( )
| A、0.5L 0.1mol/L的NaCl溶液 |
| B、100mL 0.2mol/L的MgCl2溶液 |
| C、50mL 0.2mol/L的AlCl3溶液 |
| D、1L 0.5mol/L盐酸溶液 |
在标准状况下有:①6.72L CH4 ②3.01×1023个氯化氢分子 ③13.6g硫化氢 ④0.2mol氨气.四种气体中含有的氢原子数大小顺序为( )
| A、①>③>④>② |
| B、②>③>④>① |
| C、①>④>②>③ |
| D、②>③>①>④ |
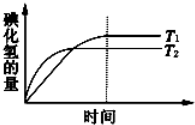 在密闭的容器中进行如下反应:H2(g)+I2(g)?2HI(g).在温度T1和T2时,产物的量与时间的关系如图所示,符合图象的正确判断是
在密闭的容器中进行如下反应:H2(g)+I2(g)?2HI(g).在温度T1和T2时,产物的量与时间的关系如图所示,符合图象的正确判断是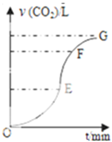 用纯净CaCO3与稀盐酸反应制取二氧化碳气体,产生气体的体积随时间的变化曲线如图所示请回答:(气体体积均在标准状况下测定).
用纯净CaCO3与稀盐酸反应制取二氧化碳气体,产生气体的体积随时间的变化曲线如图所示请回答:(气体体积均在标准状况下测定).