题目内容
1.X、Y、M、N是短周期主族元素,且原子序数依次增大.已知X的最外层电子数是电子层数的3倍,X、M同主族,Y的原子在短周期主族元素中原子半径最大.下列说法正确的是( )| A. | M的气态氢化物比N的气态氢化物稳定 | |
| B. | X、Y的简单离子半径:r(X2-)>r(Y+) | |
| C. | M与X形成的化合物对应的水化物一定是强酸 | |
| D. | Y2X和Y2X2中阴、阳离子的个数比相同,化学键类型也完全相同 |
分析 X、Y、M、N是短周期且原子序数依次增大的主族元素,X的最外层电子数是电子层数的3倍,原子只能有2个电子层,最外层电子数为6,则X为O元素;X、M同主族,则M为S元素;Y的原子在短周期主族元素中原子半径最大,则Y为Na;N的原子序数最大,故N为Cl,以此解答该题.
解答 解:X、Y、M、N是短周期且原子序数依次增大的主族元素,X的最外层电子数是电子层数的3倍,原子只能有2个电子层,最外层电子数为6,则X为O元素;X、M同主族,则M为S元素;Y的原子在短周期主族元素中原子半径最大,则Y为Na;N的原子序数最大,故N为Cl,
A.非金属性M(S)<X(Cl),故氢化物稳定性:M(S)<X(Cl),故A错误;
B.电子层结构相同的离子,离子半径随着原子序数增大而减小,所以离子半径r:r(X2-)>r(Y+),故B正确;
C.M是S元素、X是O元素,二者形成的化合物对应的水化物H2SO3是弱酸、H2SO4是强酸,故C错误;
D.Na2O中只含离子键、Na2O2中含有共价键和离子键,所以化学键类型不相同,故D错误.
故选B.
点评 本题考查原子结构和元素周期律的关系,侧重考查原子结构、物质结构、元素周期律知识,知道非金属性强弱与其氢化物稳定性的关系,注意过氧化钠中存在的化学键,题目难度不大.

练习册系列答案
相关题目
18.下列各组物质的溶液,不加任何其他试剂,就能将其一一区别出来的是( )
| A. | NaCl、Na2CO3、Ba(NO3)2、H2SO4 | B. | BaCl2、CuSO4、NaOH、NaCl | ||
| C. | NaCl、NaOH、H2SO4、Ba(NO3)2 | D. | K2SO4、BaCl2、K2CO3、KNO3 |
19.下列关于苯酚的叙述,不正确的是( )
| A. | 将苯酚晶体放人少量水中,加热至全部溶解,冷却至50℃形成悬浊液 | |
| B. | 苯酚可以和硝酸发生取代反应 | |
| C. | 苯酚易溶于NaOH溶液中 | |
| D. | 苯酚的酸性比碳酸强,比醋酸弱 |
9.食品香精菠萝酯的生产路线(反应条件略去)如下:

下列叙述错误的是( )

下列叙述错误的是( )
| A. | 苯酚和菠萝酯均可与酸性KMnO4溶液发生反应 | |
| B. | 苯酚、苯氧乙酸和菠萝酯均可与NaOH溶液发生反应 | |
| C. | 步骤(1)中由苯酚生成苯氧乙酸的反应属于取代反应 | |
| D. | 可用溴水检验步骤(2)的产物中是否有烯丙醇(CH2=CHCH2OH) 残留 |
6.下列说法正确的是( )
| A. |  的系统命名法为2,5-二甲基-4-乙基己烷 的系统命名法为2,5-二甲基-4-乙基己烷 | |
| B. | 全降解塑料(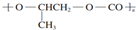 )可由单体环氧丙烷( )可由单体环氧丙烷(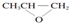 )和CO2加聚制得 )和CO2加聚制得 | |
| C. | 1mol乙酰水杨酸(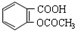 )最多可以和2molNaOH反应 )最多可以和2molNaOH反应 | |
| D. | 油脂、淀粉、蛋白质等高分子化合物都属于混合物,一定条件下均可发生水解 |
13.卤素是最活泼的一族非金属元素,下列关于卤素(用X表示)的叙述正确的是( )
| A. | 单质均能与水反应生成HXO | |
| B. | 从上到下,HX的氧化性增强,对应水溶液酸性增强 | |
| C. | 从上到下,卤素原子的电子层数依次增多,原子半径依次增大 | |
| D. | 卤素均能形成最高价含氧酸,其分子通式为HXO4 |
10.将10mL0.1mol/L的氨水与10mL0.1mol/L的盐酸混合后,溶液中各种离子的物质的量浓度由大到小的顺序是( )
| A. | c(Cl-)>c(NH4+)>c(OH-)>c(H+) | B. | c(Cl-)>c(NH4+)>c(H+)>c(OH-) | ||
| C. | c(H+)>c(OH-)>c(Cl-)>c(NH4+) | D. | c(H+)>c(Cl-)>c(NH4+)>c(OH-) |
