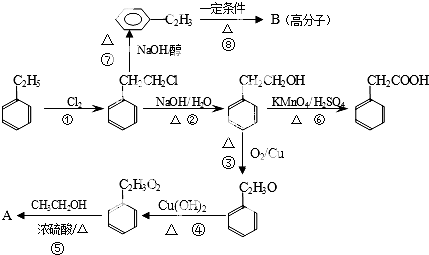
题目内容
5. 50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图上所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.
50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图上所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
(1)从实验装置上看,图中尚缺少的一种玻璃用品是环形玻璃搅拌棒.
(2)烧杯间填满碎纸条的作用是减少实验过程中的热量损失.
(3)大烧杯上如不盖硬纸板,求得的中和热数值偏小(填“偏大”“偏小”或“无影响”).
(4)该实验常用0.50mol/LHCl 和0.55mol/L的NaOH溶液各50mL.NaOH的浓度大于HCl的浓度的作用是保证盐酸完全被中和.
(5)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和热的数值会偏小(填“偏大”“偏小”或“无影响”).
分析 (1)根据量热计的构造来判断该装置的缺少仪器;
(2)中和热测定实验成败的关键是保温工作;
(3)不盖硬纸板,会有一部分热量散失;
(4)为了保证酸全部反应,碱要稍过量;
(5)弱电解质电离吸热.
解答 解:(1)根据量热计的构造可知该装置的缺少仪器是环形玻璃搅拌棒;
故答案为:环形玻璃搅拌棒;
(2)中和热测定实验成败的关键是保温工作,大小烧杯之间填满碎纸条的作用是:减少实验过程中的热量损失;
故答案为:减少实验过程中的热量损失;
(3)大烧杯上如不盖硬纸板,会有一部分热量散失,求得的中和热数值将会减小;
故答案为:偏小;
(4)NaOH的浓度大于HCl的浓度,使盐酸完全被中和,减少了盐酸挥发对实验的影响;
故答案为:保证盐酸完全被中和;
(5)一水合氨为弱碱,电离过程为吸热过程,所以用氨水代替NaOH溶液反应,反应放出的热量偏小,中和热的数值偏小;
故答案为:偏小.
点评 本题考查学生有关中和热的测定,题目难度中等,注意理解中和热的概念和测定原理是解题的关键.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
16.25℃时,下列有关0.10mol/L Na2SO3溶液的叙述正确的是(忽略溶液体积变化及被空气氧化)( )
| A. | 与漂白粉溶液反应的离子方程式:Ca2++SO32-═CaSO3↓ | |
| B. | 通入SO2至过量:c(Na+)=2[c(SO32-)+c(HSO3-)+c(H2SO3)] | |
| C. | 通入HCl至溶液pH=7:c(HSO3-)<c(Cl-) | |
| D. | 加入NaOH固体可使溶液中水的电离程度增大 |
13.下列实验设计及其对应的离子方程式均正确的是( )
| A. | 向稀HNO3中滴加Na2SO3溶液:SO32-+2H+═SO2↑+H2O | |
| B. | 用FeCl3溶液腐蚀铜来制作印刷电路板:2Fe3++Cu═2Fe2++Cu2+ | |
| C. | 向Na2SiO3溶液中通入过量SO2:SiO32-+SO2+H2O═H2SiO3↓+SO32- | |
| D. | 向Al (SO4)3溶液中加入过量的NH3•H2O:Al3++4NH3•H2O═AlO2-+4NH4++2H2O |
10.下列工业生产过程中,不涉及氧化还原反应的是( )
| A. | 用S制备H2SO4 | B. | 用CaCO3、Na2CO3、SiO2生产玻璃 | ||
| C. | 将海水中的MgSO4转变为金属Mg | D. | 用NO2生产HNO3 |
17.下列关于Li、Na、K、Rb、Cs的叙述中不正确的是( )
| A. | 金属性最强的是铯 | |
| B. | 密度随核电荷数的增加而增大 | |
| C. | 单质的熔、沸点随核电荷数的增加而降低 | |
| D. | 最高价氧化物的水化物的碱性随核电荷数的增加而增强 |
14.常温下,下列各溶液中微粒的物质的量浓度关系正确的是( )
| A. | 将pH=6的H2SO4 稀释1000倍后,c(H+)=2 c(SO42-) | |
| B. | 0.1 mol L-1的 Na2CO3溶液中:c(OH- )=c(HCO3- )+c(H+)+c(H2CO3) | |
| C. | 浓度均为0.1 mol L-1的 NaClO 溶液和 CH3COONa 溶液中,c(ClO-)<c(CH3COO-) | |
| D. | 浓度分别为0.1 mol L-1和0.01 mol L-1的CH3COOH溶液中:c(CH3COO-)前者是后者的10倍 |