题目内容
4.常温下,下列有关0.1mol•L-1Na2CO3溶液的说法正确的是( )| A. | 升高温度,促进CO32-水解,pH减小 | |
| B. | 离子浓度:c(Na+)=2[c(CO32-)+c(HCO3-)+c(H2CO3)] | |
| C. | 离子浓度:c(Na+)+c(H+)=c(HCO3-)+c(CO32-)+c(OH-) | |
| D. | 离子浓度:c(Na+)>c(CO32-)>c(OH-)>c(H+)>c(HCO3-) |
分析 A.盐的水解为吸热反应,升高温度后碳酸根离子的水解程度增大,溶液的pH增大;
B.根据碳酸钠溶液中的物料守恒判断;
C.根据碳酸钠溶液中的电荷守恒判断;
D.碳酸根离子水解生成碳酸氢根离子离子,则c(HCO3-)>c(H+).
解答 解:A.升高温度,促进CO32-水解,溶液中氢氧根离子浓度增大,溶液的pH增大,故A错误;
B.根据碳酸钠溶液中的物料守恒可得:c(Na+)=2[c(CO32-)+c(HCO3-)+c(H2CO3)],故B正确;
C.根据电荷守恒可得:c(Na+)+c(H+)=c(HCO3-)+2c(CO32-)+c(OH-),故C错误;
D.碳酸钠溶液中,碳酸根离子部分水解生成碳酸氢根离子和氢氧根离子,则c(HCO3-)>c(H+),溶液中正确的离子浓度大小为:c(Na+)>c(CO32-)>c(OH-)>c(HCO3-)>c(H+),故D错误;
故选B.
点评 本题考查了离子浓度大小比较,题目难度中等,明确盐的水解原理及其影响为解答关键,注意掌握电荷守恒、物料守恒及盐的水解原理在判断离子浓度大小中的应用方法,试题培养了学生的灵活应用能力.

练习册系列答案
相关题目
14.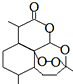 1971年,中国科学家发现、分离、提纯了用于治疗疟疾的“青蒿素”,拯救了数千万人的生命.屠呦呦起了重要的作用,因而与另两位外国科学家获得2015年诺贝尔医学奖.青蒿素分子结构如图.下列说法错误的是( )
1971年,中国科学家发现、分离、提纯了用于治疗疟疾的“青蒿素”,拯救了数千万人的生命.屠呦呦起了重要的作用,因而与另两位外国科学家获得2015年诺贝尔医学奖.青蒿素分子结构如图.下列说法错误的是( )
 1971年,中国科学家发现、分离、提纯了用于治疗疟疾的“青蒿素”,拯救了数千万人的生命.屠呦呦起了重要的作用,因而与另两位外国科学家获得2015年诺贝尔医学奖.青蒿素分子结构如图.下列说法错误的是( )
1971年,中国科学家发现、分离、提纯了用于治疗疟疾的“青蒿素”,拯救了数千万人的生命.屠呦呦起了重要的作用,因而与另两位外国科学家获得2015年诺贝尔医学奖.青蒿素分子结构如图.下列说法错误的是( )| A. | 青蒿素可以起取代反应 | B. | 青蒿素中的氧均为-2价 | ||
| C. | 青蒿素可以和NaOH溶液反应 | D. | 青蒿素的分子式为C15H22O5 |
12.下列各组反应的最终产物中,肯定有白色沉淀的是( )
| A. | 向AlCl3溶液中加入过量氨水 | B. | 向Al2(SO4)3溶液中加入过量KOH溶液 | ||
| C. | 向澄清石灰水中通入过量CO2 | D. | 向NaAlO2溶液中加入过量稀盐酸 |
19.下列物质的水溶液能导电,但属于非电解质的是( )
| A. | Cl2 | B. | BaSO4 | C. | SO2 | D. | CH3COOH |
9.配制100mL 1mol/LNaOH溶液,下列说法正确的是( )
| A. | 在托盘天平两托盘上各放一片相同的纸,然后将NaOH放在纸片上进行称量 | |
| B. | 配制溶液时,若加水超过容量瓶刻度,应用胶头滴管将多余溶液吸出 | |
| C. | 用蒸馏水洗涤烧杯、玻璃棒2-3次,洗涤液也移入容量瓶中 | |
| D. | 定容时俯视容量瓶的刻度线,会造成所配溶液物质的量浓度偏低 |
13.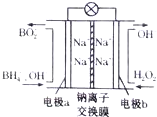 据报道,以硼氢化合物NaBH4(B元素的化合价为+3价)和H2O2作原料的燃料电池,其负极材料采用Pt/C,正极材料采用MnO2,可用作空军通信卫星电源,其工作原理如图所示.下列说法正确的是( )
据报道,以硼氢化合物NaBH4(B元素的化合价为+3价)和H2O2作原料的燃料电池,其负极材料采用Pt/C,正极材料采用MnO2,可用作空军通信卫星电源,其工作原理如图所示.下列说法正确的是( )
 据报道,以硼氢化合物NaBH4(B元素的化合价为+3价)和H2O2作原料的燃料电池,其负极材料采用Pt/C,正极材料采用MnO2,可用作空军通信卫星电源,其工作原理如图所示.下列说法正确的是( )
据报道,以硼氢化合物NaBH4(B元素的化合价为+3价)和H2O2作原料的燃料电池,其负极材料采用Pt/C,正极材料采用MnO2,可用作空军通信卫星电源,其工作原理如图所示.下列说法正确的是( )| A. | 该电池的负极反应为BH4-+8OH--8e-═BO2-+6H2O | |
| B. | 电池放电时Na+从b极区移向a极区 | |
| C. | 每消耗3mol H2O2,转移的电子为3mol | |
| D. | 电极a采用Mn02作电极材料 |
14.关于具有相同的电子层结构的短周期元素aA2+、bB+、cC3+、dD-,下列说法中正确的是( )
| A. | 原子半径C>A>B>D | B. | 价电子数D>C>A>B | ||
| C. | 离子半径C3+>D->B+>A2+ | D. | 单质的还原性A>B>C>D |