题目内容
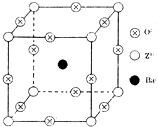 已知X、Y和Z三种元素的原子序数之和等于48.X的一种1:1型氢化物分子中既有σ键又有π键.Z是金属元素,Z的单质和化合物有广泛的用途.已知Z的核电荷数小于28,且次外层有2个未成对电子.工业上利用ZO2和碳酸钡在熔融状态下制取化合物M(M可看做一种含氧酸盐).M有显著的“压电性能”,应用于超声波的发生装置.经X射线分析,M晶体的最小重复单位为正方体(如图),边长为4.03×10-10m,顶点位置为Z4+所占,体心位置为Ba2+所占,所有棱心位置为O2-所占.
已知X、Y和Z三种元素的原子序数之和等于48.X的一种1:1型氢化物分子中既有σ键又有π键.Z是金属元素,Z的单质和化合物有广泛的用途.已知Z的核电荷数小于28,且次外层有2个未成对电子.工业上利用ZO2和碳酸钡在熔融状态下制取化合物M(M可看做一种含氧酸盐).M有显著的“压电性能”,应用于超声波的发生装置.经X射线分析,M晶体的最小重复单位为正方体(如图),边长为4.03×10-10m,顶点位置为Z4+所占,体心位置为Ba2+所占,所有棱心位置为O2-所占.(1)Z4+的核外电子排布式为
(2)X在该氢化物中以
(3)①在M晶体中,若将Z“置于立方体的体心,Ba2+置于立方体的顶点,则O2-处于立方体的
(4)制备M的化学反应方程式是
考点:晶胞的计算
专题:
分析:Z的核电荷数小于28,且次外层有2个未成对电子,其价层电子排布应当是3d24s2,所以Z为Ti元素,X的一种1:1型氢化物分子中既有σ键又有π键,应为H-C≡C-H,则X为C元素,X、Y和Z三种元素的原子序数之和等于48,则Y的原子序数为20,应为Ca元素,
(1)根据能量最低原理书写电子排布式;
(2)X的氢化物为H-C≡C-H,根据结构和成键特点判断杂化方式,根据不同类型晶体的性质判断熔点高低;
(3)①根据图,在M晶体中,顶点位置为Z4+所占,体心位置为Ba2+所占,所有棱心位置为O2-所占,利用均摊法可知,晶胞中Ti、Ba、O的个数比为(8×
):1:(12×
)=1:1:3,若将Z4+置于立方体的体心,Ba2+置于立方体的顶点,要使晶胞中Ti、Ba、O的个数比仍为1:1:3,则O2-只能处于立方体的面心,据此答题;
②根据晶胞的结构判断;
(4)根据晶胞确定该化合物的化学式,根据题意,高温条件下,二氧化钛和碳酸钡反应生成BaTiO3和CO2,据此写化学方程式;
(1)根据能量最低原理书写电子排布式;
(2)X的氢化物为H-C≡C-H,根据结构和成键特点判断杂化方式,根据不同类型晶体的性质判断熔点高低;
(3)①根据图,在M晶体中,顶点位置为Z4+所占,体心位置为Ba2+所占,所有棱心位置为O2-所占,利用均摊法可知,晶胞中Ti、Ba、O的个数比为(8×
| 1 |
| 8 |
| 1 |
| 4 |
②根据晶胞的结构判断;
(4)根据晶胞确定该化合物的化学式,根据题意,高温条件下,二氧化钛和碳酸钡反应生成BaTiO3和CO2,据此写化学方程式;
解答:
解:Z的核电荷数小于28,且次外层有2个未成对电子,其价层电子排布应当是3d24s2,所以Z为Ti元素,X的一种1:1型氢化物分子中既有σ键又有π键,应为H-C≡C-H,则X为C元素,X、Y和Z三种元素的原子序数之和等于48,则Y的原子序数为20,应为Ca元素,
(1)钛是22号元素,根据能量最低原理,钛离子的电子排布式为:1s22s22p63s23p6;
(2)X的氢化物为H-C≡C-H,碳原子形成2个δ键,无孤电子对,所以碳为为sp杂化,X和Y形成的化合物是CaC2,是离子化合物,形成离子晶体,而C2H2是共价化合物,形成分子晶体,所以,CaC2的熔点高于C2H2,故答案为:sp; 高于;
(3)①根据图,在M晶体中,顶点位置为Z4+所占,体心位置为Ba2+所占,所有棱心位置为O2-所占,利用均摊法可知,晶胞中Ti、Ba、O的个数比为(8×
):1:(12×
)=1:1:3,若将Z4+置于立方体的体心,Ba2+置于立方体的顶点,要使晶胞中Ti、Ba、O的个数比仍为1:1:3,则O2-只能处于立方体的面心,
故答案为:面心;
②根据晶胞的结构可知,每个Ti4+周围有6个O2-,所以Ti4+的配位数为6,故答案为:6;
(4)根据(3)①可知,M的化合物的化学式为BaCO3,根据题意,高温条件下,二氧化钛和碳酸钡反应生成BaTiO3和CO2,所以化学方程式为TiO2+BaCO3
BaTiO3+CO2↑,故答案为:TiO2+BaCO3
BaTiO3+CO2↑;
(1)钛是22号元素,根据能量最低原理,钛离子的电子排布式为:1s22s22p63s23p6;
(2)X的氢化物为H-C≡C-H,碳原子形成2个δ键,无孤电子对,所以碳为为sp杂化,X和Y形成的化合物是CaC2,是离子化合物,形成离子晶体,而C2H2是共价化合物,形成分子晶体,所以,CaC2的熔点高于C2H2,故答案为:sp; 高于;
(3)①根据图,在M晶体中,顶点位置为Z4+所占,体心位置为Ba2+所占,所有棱心位置为O2-所占,利用均摊法可知,晶胞中Ti、Ba、O的个数比为(8×
| 1 |
| 8 |
| 1 |
| 4 |
故答案为:面心;
②根据晶胞的结构可知,每个Ti4+周围有6个O2-,所以Ti4+的配位数为6,故答案为:6;
(4)根据(3)①可知,M的化合物的化学式为BaCO3,根据题意,高温条件下,二氧化钛和碳酸钡反应生成BaTiO3和CO2,所以化学方程式为TiO2+BaCO3
| ||
| ||
点评:本题主要考查了核外电子排布、原子杂化轨道、晶体的性质、晶胞的结构及化学方程式的书写,中等难度,解题的关键在于元素的推断.

练习册系列答案
相关题目
下列数字为几种元素的核电荷数,其中原子核外最外层电子数最多的是( )
| A、8 | B、14 | C、17 | D、19 |
下列有关原子核外电子排布的说法正确的是( )
| A、离核较近区域运动的电子能量较高 |
| B、M层最多容纳的电子数不超过8 |
| C、K层为最外电子层时最多只能容纳8个电子 |
| D、稀有气体元素的原子形成了稳定的电子层结构 |
下列关于有机物的叙述正确的是( )
| A、石油的分馏和裂化均属于化学变化 |
| B、乙醇、乙酸能用碳酸钠溶液、紫色石蕊溶液、酸性高锰酸钾溶液等多种方法鉴别 |
| C、油脂、塑料、天然橡胶都是高分子化合物 |
| D、因为葡萄糖在糖类结构中最简单,因此它是一种单糖 |
常温下,水的离子积为Kw,下列说法正确的是( )
| A、在pH=11的溶液中,水电离出的c(OH-)一定等于10-3mol/L |
| B、将pH=1的酸和pH=13的碱溶液等体积混合后,溶液的pH一定等于7 |
| C、一元酸HA与一元碱BOH混合后,溶液中c(A-)=c(B+),则溶液呈中性 |
| D、若强酸、强碱中和后溶液的pH=7,则中和之前酸、碱的pH之和一定等于14 |
 已知:硫酸铜溶液中滴入氨基乙酸钠(H2N-CH2-COONa)即可得到配合物A.其结构如图1:
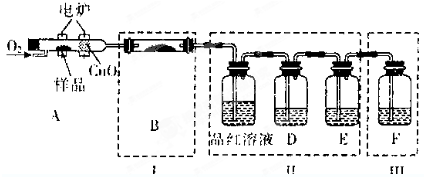
已知:硫酸铜溶液中滴入氨基乙酸钠(H2N-CH2-COONa)即可得到配合物A.其结构如图1: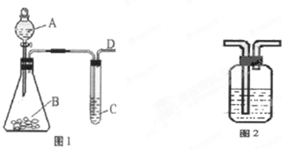 某同学用如图1所示的装置来探究SO2的性质及有关实验.
某同学用如图1所示的装置来探究SO2的性质及有关实验.