题目内容
12. 短周期元素甲~戊的原子序数依次增大,结合表中信息,回答有关问题.
短周期元素甲~戊的原子序数依次增大,结合表中信息,回答有关问题.| 甲 | 乙 | 丙 | 丁 | 戊 | |
| 主要化合价 | +1、-1 | +4、-4 | |||
| 性质或结构信息 | 同位素有3种 | 同素异形体有多种 | 2s22p4 | 五种原子中原子半径最大,未成对电子数为0 | 有两种常见氧化物,其中一种是大气污染物 |
(2)丁元素与其同周期相邻两种元素原子的第一电离能由大到小的顺序为Mg>Al>Na(用元素符号表示),试解释原因Mg电子排布3s全满结构,第一电离能异常增大.
(3)由甲乙丙、甲丙戊组成的两种离子的钠盐可以反应,离子方程式是HCO3-+HSO3-=H2O+CO2↑+SO32-;HCO3-+H+=H2O+CO2↑.
(4)乙、戊在最高价酸根中的杂化类型分别是sp2、sp3.
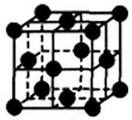
(5)单质铜晶体的堆积方式如图所示,设晶胞边长为a cm,阿伏伽德罗常数用NA表示,则晶胞中原子的配位数为12,晶体的密度为$\frac{256}{{a}^{3}{N}_{A}}$g•cm-3(要求写表达式,可以不简化).
分析 主族元素中,元素最高化合价与其族序数相同,其最低化合价=族序数-8,根据表中数据知,甲为H元素、乙为C元素、丙为O元素、丁为Mg元素、戊为S元素,
(1)乙为C元素,其最外层有4个电子,但未成对电子数是2,一种能级有一种电子云形状;
(2)同一周期元素,元素第一电离能随着原子序数增大而呈增大趋势,原子核外轨道中电子处于全满、全空、半满时原子较稳定;
(3)甲乙丙、甲丙戊组成的两种离子的钠盐分别是碳酸氢钠、硫酸氢钠,碳酸氢根离子和亚硫酸氢根离子能发生复分解反应,碳酸氢根离子和氢离子反应生成二氧化碳和水;
(4)乙、戊的最高价酸根离子分别是碳酸、硫酸,根据价层电子对互斥理论判断中心原子杂化方式;
(5)铜为面心立方晶胞,铜原子配位数=3×8÷2;该晶胞中Cu原子个数=8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,其密度=$\frac{\frac{M}{{N}_{A}}×4}{V}$.
解答 解:主族元素中,元素最高化合价与其族序数相同,其最低化合价=族序数-8,根据表中数据知,甲为H元素、乙为C元素、丙为O元素、丁为Mg元素、戊为S元素,
(1)乙为C元素,其最外层有4个电子,但未成对电子数是2,一种能级有一种电子云形状,所以该原子电子云形状有2种,故答案为:2;2;
(2)同一周期元素,元素第一电离能随着原子序数增大而呈增大趋势,原子核外轨道中电子处于全满、全空、半满时原子较稳定,Mg电子排布3s全满结构,第一电离能异常增大,所以其第一电离能大小顺序是Mg>Al>Na,故答案为:Mg>Al>Na;Mg电子排布3s全满结构,第一电离能异常增大;
(3)甲乙丙、甲丙戊组成的两种离子的钠盐分别是碳酸氢钠、硫酸氢钠,碳酸氢根离子和亚硫酸氢根离子能发生复分解反应,碳酸氢根离子和氢离子反应生成二氧化碳和水,离子方程式分别为HCO3-+HSO3-=H2O+CO2↑+SO32-、HCO3-+H+=H2O+CO2↑,
故答案为:HCO3-+HSO3-=H2O+CO2↑+SO32-;HCO3-+H+=H2O+CO2↑;
(4)乙、戊的最高价酸根离子分别是碳酸、硫酸,碳酸根离子中C原子价层电子对个数是3且不含孤电子对,硫酸根离子中S原子价层电子对个数是4且不含孤电子对,根据价层电子对互斥理论判断中心原子杂化方式分别为sp2、sp3,故答案为:sp2、sp3;
(5)铜为面心立方晶胞,铜原子配位数=3×8÷2=12;该晶胞中Cu原子个数=8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,其密度=$\frac{\frac{M}{{N}_{A}}×4}{V}$=$\frac{\frac{64}{{N}_{A}}×4}{{a}^{3}}$g•cm-3=$\frac{256}{{a}^{3}{N}_{A}}$g•cm-3,
故答案为:12;$\frac{256}{{a}^{3}{N}_{A}}$.
点评 本题考查物质结构和性质,为高频考点,涉及晶胞计算、原子杂化方式判断、元素周期律等知识点,侧重考查学生分析计算及空间想象能力,难点是晶胞计算.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | 非金属元素既可以形成阴离子,也可以形成阳离子 | |
| B. | 金属元素只能形成阳离子 | |
| C. | 分子式相同的物质化学性质相同 | |
| D. | 单核阳离子,其最外层均具有2电子或8电子的结构 |
| A. | 分类方法、统计方法、定量研究、实验方法和模型化方法等是化学研究的常用方法 | |
| B. | 电解熔融氧化铝、粗硅的制取、生物炼铜、煤焦油中提取苯等过程都涉及化学变化 | |
| C. | 从2016年1月1号开始浙江省汽油标准由“国Ⅳ”提高到“国V”,但这并不意味着汽车不再排放氮氧化物 | |
| D. | 纳米技术、分子设计技术的发展,将使分子晶体管、分子芯片、分子导线、分子计算机等化学器件得到广泛的应用 |
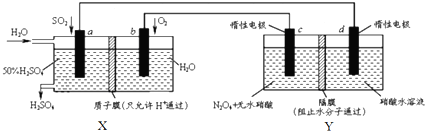
| A. | X是原电池,能够生产硫酸.Y是电解池,能够生产N2O5 | |
| B. | c电极的电极反应方程式为:N2O4+2HNO3-2e-=2N2O5+2H+ | |
| C. | 当电路中通过2mol e-,X、Y中各有1molH+从左边迁移到右边 | |
| D. | 为保证X中硫酸的质量分数不变,则加入的n(so2):n(H2O)=1:7.4 |
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 将浓氨水加到盛有AgCl固体的试管中 | AgCl固体完全溶解 | 所得溶液中c(Ag+)•c(Cl-) ≤Ksp(AgCl) |
| B | 向FeI2溶液中通入少量的氯气,再向反应后的溶液中滴加KSCN溶液 | 溶液变为红色 | Cl2能将Fe2+氧化成Fe3+ |
| C | 向固体纯碱中滴加足量浓盐酸,将产生的气体通入苯酚钠溶液 | 溶液变浑浊 | 酸性:盐酸>碳酸>苯酚 |
| D | 向两份蛋白质溶液中分别滴加饱和NaCl溶液和CuSO4溶液 | 均有固体析出 | 蛋白质均发生变性 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 非金属性:Y<X<W | |
| B. | 简单气态氢化物的热稳定性:Y<X | |
| C. | 化合物ZW、XY中化学键类型相同 | |
| D. | X、W的最高价氧化物的水化物均为强酸 |
下列叙述正确的是( )
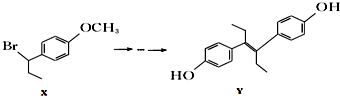
| A. | 化合物x中不含有手性碳原子 | |
| B. | 1mol化合物Y与浓溴水反应,最多消耗5mol Br2 | |
| C. | 在一定条件下化合物Y能发生加聚反应、缩聚反应 | |
| D. | 在氢氧化钠水溶液中加热,化合物X能发生消去反应 |
| A. | 碳原子间都以单链相连的链烃是烷烃 | |
| B. | 所有糖类物质都有甜味 | |
| C. | 油与脂肪都属于甘油酯 | |
| D. | 葡萄糖与果糖互为同分异构体 |