题目内容
18.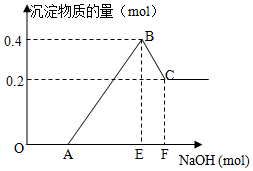 在HCl、MgCl2和AlCl3的混合溶液中滴加NaOH溶液至过量,如图
在HCl、MgCl2和AlCl3的混合溶液中滴加NaOH溶液至过量,如图(1)写出各段所发生反应的离子方程式:
OA:H++OH-═H2O
BC:Al(OH)3+OH-═AlO2-+2H2O
(2)C点时,白色沉淀的化学式Mg(OH)2
(3)原溶液中Mg2+、Al3+的物质的量浓度之比为1:1
(4)图中AE:EF=5:1.
分析 在HCl、MgCl2和AlCl3的混合溶液中,滴加NaOH溶液至过量,OA段发生反应为:H++OH-═H2O,AB段沉淀开始增大至最大的反应为:MgCl2+2NaOH═2NaCl+Mg(OH)2↓、AlCl3+3NaOH═3NaCl+Al(OH)3↓,BC段沉淀溶解,发生反应为:Al(OH)3+OH-═AlO2-+2H2O,根据图象可知氢氧化镁沉淀的物质的量为0.2mol,则氢氧化铝沉淀的物质的量为0.4mol-0.2mol=0.2mol,根据质量守恒定律可计算出镁离子、铝离子的浓度之比;根据镁离子、铝离子的物质的量可计算出AE:EF,据此进行解答.
解答 解:在HCl、MgCl2和AlCl3的混合溶液中,滴加NaOH溶液至过量,OA段发生反应为:H++OH-═H2O,AB段沉淀开始增大至最大的反应为:Mg2++2OH-═Mg(OH)2↓、Al3++3OH-═Al(OH)3↓,BC段沉淀溶解,发生反应为:Al(OH)3+OH-═AlO2-+2H2O,
故答案为:H++OH-═H2O;Al(OH)3+OH-═AlO2-+2H2O;
(2)C点时氢氧化铝沉淀完全溶解,剩余的白色沉淀为氢氧化镁,其化学式为:Mg(OH)2,
故答案为:Mg(OH)2;
(3)根据图象可知,C点之后剩余的沉淀为Mg(OH)2,Mg(OH)2的物质的量为0.2mol,则氢氧化铝沉淀的物质的量为:0.4mol-0.2mol=0.2mol,
根据质量守恒定律可知:n(Mg2+)=[Mg(OH)2]=0.2mol、n(Al3+)=n[Al(OH)3]=0.2mol,由于在同一溶液中,则镁离子、铝离子的物质的量浓度之比等于其物质的量之比,所以原溶液中Mg2+、Al3+的物质的量浓度之比为:0.2mol:0.2mol=1:1,
故答案为:1:1;
(4)AB段消耗NaOH的物质的量为:0.2mol×2+0.2mol×3=1mol,BC段消耗NaOH的物质的量为:0.2mol,所以AE:EF=1mol:0.2mol=5:1,
故答案为:5:1.
点评 本题考查离子方程式的计算,题目难度中等,明确图象曲线变化对应反应原理及反应的先后顺序为解答关键,注意掌握守恒思想在化学计算中的应用方法,试题培养了学生的分析能力及化学计算能力.

 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案| A. | 容量瓶中原有少量蒸馏水 | |
| B. | 称量药品时间过长 | |
| C. | 定容时俯视液面 | |
| D. | 洗涤烧杯和玻棒的溶液转入容量瓶中 |
| A. | 2.3g | B. | 2.93g | C. | 1.15g | D. | 4.6g |
| A. | 单质的还原性:W>Y | |
| B. | 最高价氧化物对应的水化物的酸性:X>Z | |
| C. | W的阳离子和Z的阴离子均能促进水的电离 | |
| D. | 由W、Y、Z三种元素组成的化合物既含离子键又含共价键 |
| A. | 将湿润的红色石蕊试纸放在打开的瓶口 | |
| B. | 将湿润的蓝色石蕊试纸放在打开的瓶口 | |
| C. | 用蘸有浓硫酸的玻璃棒靠近打开的瓶口. | |
| D. | 将干燥的红色石蕊试纸放在瓶口 |
 =2Cr(OH)3↓+3O2↑+2H2O
=2Cr(OH)3↓+3O2↑+2H2O
 表中表示的一些物质或概念间的从属关系中不正确的是( )
表中表示的一些物质或概念间的从属关系中不正确的是( )