��Ŀ����
6��I��þ���Ͻ�Mg17Al12����һ��DZ�ڵ�������ϣ�������������£���һ����ѧ�����ȵ�Mg��A1������һ���¶���������ã��úϽ���һ����������ȫ����ķ�Ӧ����ʽΪMg17Al12+17H2=17MgH2+12Al���õ��Ļ����Y��17MgH2+12Al����һ�������¿��ͷų������� �������Ʊ�þ���Ͻ�Mg17Al12��ʱͨ�������Ŀ�Ƿ�ֹMg Al��������������6.0mol•L-1HCl ��Һ�У������Y ����ȫ�ͷų�H2.1mol Mg17Al12��ȫ�����õ��Ļ����Y ������������ȫ��Ӧ���ͷų�H2�����ʵ���Ϊ52mol
��ijһ��Ӧ��ϵ�з�Ӧ��������ﹲ�������ʣ�O2��H2CrO4��Cr��OH��3��H2O��H2O2
��֪�÷�Ӧ��H2O2ֻ�������¹��̣�H2O2��O2
��1���÷�Ӧ�еĻ�ԭ����H2O2
��2���÷�Ӧ�У�������ԭ��Ӧ�Ĺ�����H2CrO4��Cr��OH��3
��3��д���÷�Ӧ�Ļ�ѧ����ʽ�����������ת�Ƶķ������Ŀ
 =2Cr��OH��3��+3O2��+2H2O
=2Cr��OH��3��+3O2��+2H2O��4������Ӧת����0.3mol���ӣ�������������ڱ�״�������Ϊ3.36L��
���� I����þ����������Ԫ�أ��ױ�����������
���ͷų���H2 ����Mg17Al12���յ��⣬������þ���������ᷴӦ���ɵ�������
II���÷�Ӧ��H2CrO4��Cr��OH��3��CrԪ�صĻ��ϼ۽��ͣ���Ӧ��H2CrO4Ϊ������������ԭΪCr��OH��3������H2O2ֻ�������¹��̣�H2O2��O2��OԪ�ػ��ϼ����ߣ�H2O2������������ԭ�������ݻ��ϼ۵ı仯��֪����Ӧ�ķ���ʽΪ2H2CrO4+3H2O2=2Cr��OH��3+3O2��+2H2O�����ݻ��ϼ۵ı仯�жϵ���ת�Ƶ���Ŀ���Դ˽����⣮
��� �⣺I����Mg��Al���ǻ��õĽ������ʣ����ױ������е�����������ͨ����������������Է�ֹ���߱�������
�ʴ�Ϊ����ֹMg Al������������
��1molMg17Al12��ȫ����17mol���������л�ȫ���ͷų�����þ���Ͻ��е�þ�������������ᷴӦ����H2���������������ʵ����ֱ�Ϊ17mol��12��$\frac{3}{2}$=18mol������������һ����17+17+18��mol=52mol��
�ʴ�Ϊ��52mol��
II����1��H2CrO4��Cr��OH��3��CrԪ�صĻ��ϼ۽��ͣ���Ӧ��H2CrO4Ϊ����������Ӧ����H2O2��O2����Ԫ�صĻ��ϼ���-1��������0�ۣ�����H2O2�ǻ�ԭ����
�ʴ�Ϊ��H2O2��
��2��H2CrO4����ԭ��������������ԭ��Ӧ�Ĺ���ΪH2CrO4��Cr��OH��3���ʴ�Ϊ��H2CrO4��Cr��OH��3��
��3���÷�Ӧ��OԪ��ʧ���ӣ�CrԪ�صõ����ӣ�2molH2CrO4��Ӧת�Ƶ���Ϊ2mol����6-3��=6mol�����õ����ŷ��������ת�Ƶķ������ĿΪ =2Cr��OH��3��+3O2��+2H2O��
=2Cr��OH��3��+3O2��+2H2O��
�ʴ�Ϊ�� =2Cr��OH��3��+3O2��+2H2O��
=2Cr��OH��3��+3O2��+2H2O��
��4����2H2CrO4+3H2O2�T2Cr��OH��3��+3O2��+2H2O��֪������3mol����ת��6mol���ӣ���ת����0.3mol���ӣ����������������ʵ���Ϊ$\frac{0.3mol}{6}$mol��3=0.15mol�����ڱ�״�������Ϊ0.15mol��22.4L/mol=3.36L���ʴ�Ϊ��3.36L��
���� ���⿼��������ԭ��Ӧ��Ϊ�߿��������ͣ����շ�Ӧ��Ԫ�صĻ��ϼ۱仯Ϊ���Ĺؼ�������������ԭ��Ӧ�������ת�Ƶ��ӵĿ��飬��Ŀ�ѶȲ���

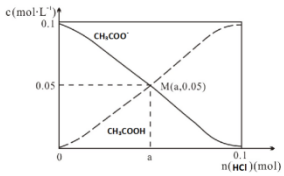
| A�� | M����Һ��ˮ�ĵ���̶ȱ�ԭ��ҺС | |
| B�� | ��M��ʱ��n��H+��-n��OH-��=��0.05-a ��mol | |
| C�� | ����HCl�ļ��룬$\frac{c��O{H}^{-}��}{c��C{H}_{3}COO{H}^{-}��}$���ϼ�С | |
| D�� | ��n��HCl��=0.1molʱ��c��Cl-����c��CH3COOH����c��H+�� |
| A�� | 3�� | B�� | 4�� | C�� | 5�� | D�� | 6�� |
| A�� | ������̼���������Ҫ�ɷ� | |
| B�� | ������һ����������ȼ�� | |
| C�� | ̼�����ƿ���������θ����� | |
| D�� | �Ȼ�����Һ����������ӡˢͭ��·�� |
 CH3OH��
CH3OH�� ��
��
 2015��8��12��23��30���ң�������������һ����װ����ͷ������ը��������ը���Ǽ�װ���ڵ���ȼ�ױ���Ʒ�軯�ƣ�����Ϊ700�����ң�
2015��8��12��23��30���ң�������������һ����װ����ͷ������ը��������ը���Ǽ�װ���ڵ���ȼ�ױ���Ʒ�軯�ƣ�����Ϊ700�����ң�
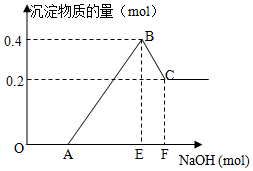 ��HCl��MgCl2��AlCl3�Ļ����Һ�еμ�NaOH��Һ����������ͼ
��HCl��MgCl2��AlCl3�Ļ����Һ�еμ�NaOH��Һ����������ͼ