题目内容
3.有一在空气中暴露过的Na固体,经分析含极少量NaOH、Na2CO3,取mg该样品投入25mL浓度为2mol/L的盐酸中,固体和盐酸恰好都反应完全,则mg该样品中钠元素质量为( )| A. | 2.3g | B. | 2.93g | C. | 1.15g | D. | 4.6g |
分析 Na、NaOH、Na2CO3均与盐酸反应生成NaCl,恰好都反应完全,溶质为NaCl,结合原子守恒计算.
解答 解:Na、NaOH、Na2CO3均与盐酸反应生成NaCl,恰好都反应完全,溶质为NaCl,则n(Na)=n(NaCl)=n(HCl)=0.025L×2mol/L=0.05mol,可知mg该样品中钠元素质量为0.05mol×23g/mol=1.15g,
故选C.
点评 本题考查混合物的计算,为高频考点,把握反应后溶液中的溶质、原子守恒为解答的关键,侧重分析与计算能力的考查,注意守恒法的应用,题目难度不大.

练习册系列答案
 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案
相关题目
13.下列根据实验操作和现象所得出的结论正确的是( )
| 选项 | 实验操作 | 实验现象 | 结 论 |
| A | 用铂丝蘸取溶液进行焰色反应 | 火焰呈黄色 | 溶液中无K+ |
| B | 向溶液中先滴加稀盐酸,再滴加BaCl2溶液 | 先滴加稀盐酸无现象,滴加BaCl2后出现白色沉淀 | 溶液中一定含有SO42- |
| C | 向一定浓度的CuSO4溶液中通入适量H2S气体 | 出现黑色沉淀 | H2S的酸性比H2SO4强 |
| D | 向某溶液中滴加稀NaOH溶液,将湿润红色石蕊试纸置于试管口 | 试纸不变蓝 | 原溶液中无NH4+ |
| A. | A | B. | B | C. | C | D. | D |
11.常温下,向1L0.1mol•L-1CH3COONa溶液中,不断通入HCl气体.CH3COO-与CH3COOH 的变化趋势如图所示(假设HCl完全吸收且不考虑CH3COOH挥发及溶液体积变化),下列说法不正确的是( )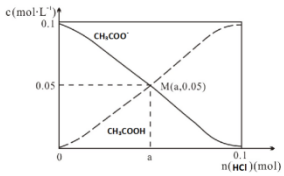

| A. | M点溶液中水的电离程度比原溶液小 | |
| B. | 在M点时,n(H+)-n(OH-)=(0.05-a )mol | |
| C. | 随着HCl的加入,$\frac{c(O{H}^{-})}{c(C{H}_{3}COO{H}^{-})}$不断减小 | |
| D. | 当n(HCl)=0.1mol时,c(Cl-)>c(CH3COOH)>c(H+) |
15.CO2、MgO、Na2SO4溶液、Ba(OH)2溶液、盐酸五种物质,在常温下两种物质间能发生的化学反应有( )
| A. | 3个 | B. | 4个 | C. | 5个 | D. | 6个 |
12.下列有关硫及其化合物的说法不正确的是( )
| A. | 硫单质在过量的空气中燃烧生成SO2 | |
| B. | 自然界的硫元素主要以硫化物和硫酸盐等形式存在,无硫单质 | |
| C. | 二氧化硫和氯气使品红溶液褪色的原理不相同 | |
| D. | 浓硫酸与碳在一定条件下的反应,体现了浓硫酸的强氧化性 |
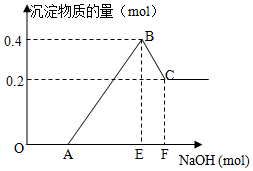 在HCl、MgCl2和AlCl3的混合溶液中滴加NaOH溶液至过量,如图
在HCl、MgCl2和AlCl3的混合溶液中滴加NaOH溶液至过量,如图


