题目内容
向500mL稀硝酸中加入一定质量的铁粉,铁粉完全溶解后,放出NO气体5.6升,同时溶液质量增加9.3克,则反应后c(Fe2+):c(Fe3+)为 .
考点:化学方程式的有关计算
专题:计算题
分析:溶液质量增重为参加反应Fe的质量与生成NO的质量之差,再根据电子转移守恒列方程计算溶液中n(Fe2+)、n(Fe3+),进而计算二者浓度之比.
解答:
解:生成NO的物质的量为
=0.25mol,
设Fe2+、Fe3+的物质的量分别为xmol、ymol,
由溶液质量增重9.3g,则:(x+y)mol×56g/mol-0.25mol×30g/mol=9.3g
由电子转移守恒,则:2xmol+3ymol=0.25mol×3
联立方程,解得x=0.15 y=0.15
反应后c(Fe2+):c(Fe3+)为=0.15mol:0.15mol=1:1,
故答案为:1:1.
| 5.6L |
| 22.4L/mol |
设Fe2+、Fe3+的物质的量分别为xmol、ymol,
由溶液质量增重9.3g,则:(x+y)mol×56g/mol-0.25mol×30g/mol=9.3g
由电子转移守恒,则:2xmol+3ymol=0.25mol×3
联立方程,解得x=0.15 y=0.15
反应后c(Fe2+):c(Fe3+)为=0.15mol:0.15mol=1:1,
故答案为:1:1.
点评:本题考查化学方程式有关计算,理解溶液质量增重是解题关键,注意利用守恒法解答,难度中等.

练习册系列答案
相关题目
短周期元素甲、乙、丙、丁的原子序数依次增大,甲和乙的气态化合物的水溶液呈碱性,甲与丙同主族,丁元素原子最外层电子数与其电子层数相等.下列说法正确的是( )
| A、原子半径:丁>丙>甲 |
| B、单质的还原性:丁>丙>甲 |
| C、甲、乙、丙的氧化物为共价化合物 |
| D、乙、丙、丁的最高价氧化物对应的水化物相互反应 |
 如图表示在某溶液中滴加Ba(OH)2溶液时,沉淀的物质的量随Ba(OH)2的物质的量的变化关系.该溶液的成分可能是( )
如图表示在某溶液中滴加Ba(OH)2溶液时,沉淀的物质的量随Ba(OH)2的物质的量的变化关系.该溶液的成分可能是( )| A、NH4Al(SO4)2 |
| B、KAl(SO4)2 |
| C、Al2(SO4)3 |
| D、NaAlO2 |
图象是一种简洁表示化学变化过程的方法,下列相关反应的图象中错误的是( )
A、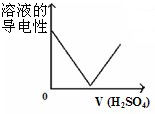 将一定量稀硫酸滴入到同浓度的Ba(OH)2溶液中 将一定量稀硫酸滴入到同浓度的Ba(OH)2溶液中 |
B、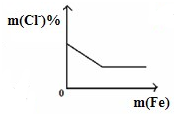 将铁粉加入到一定量FeCl3溶液中 将铁粉加入到一定量FeCl3溶液中 |
C、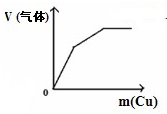 将铜粉加入到一定量浓硝酸中 将铜粉加入到一定量浓硝酸中 |
D、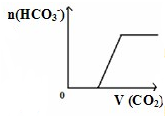 将二氧化碳通入到一定量漂粉精溶液中 将二氧化碳通入到一定量漂粉精溶液中 |
 元素周期表是指导我们系统学习化学的重要工具.下表是元素周期表的一部分:
元素周期表是指导我们系统学习化学的重要工具.下表是元素周期表的一部分: