题目内容
1.A、B、C、D、E五种短周期元素,原子序数依次增大,A、E同主族,A元素的原子半径最小,B元素原子的最外层电子数是内层电子数的2倍,C元素原子的电子层数为n,最外层电子数为2n+l,A、B、C、E每种元素都能与D元素组成两种或两种以上的常见化合物. 回答下列问题:(1)写出下列各元素符号:CN ENa
(2)A和C形成的最简单化合物的电子式为
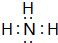 ,A和D按原子数1:1形成的化合物的结构式为H-O-O-H.
,A和D按原子数1:1形成的化合物的结构式为H-O-O-H.(3)已知:BA3DA(g)+A2D(g)=BD2(g)+3A2(g)△H=+49.0kJ/mol
BA3DA(g)+$\frac{1}{2}$D2(g)=BD2(g)+2A2(g)△H=-192.9kJ/mol
试写出:气态BA3DA完全燃烧生成气态A2D的热化学方程式(用推出的元素符号写,下同)CH3OH(g)+$\frac{3}{2}$O2(g)=CO2(g)+2H2O(g)△H=-676.7KJ•mol-1.
利用该燃烧反应设计成的燃料电池正逐步得到推广,请写出该燃料电池负极电极反应式(电解质溶液为KOH):CH3OH-6e-+8OH-=CO32-+6H2O.
分析 A元素的原子半径最小,可知A是氢元素;B元素原子的最外层电子数是内层电子数的2倍,由于最外层电子数不超过8,原子只能有2个电子层,最外层电子数为4,故B是碳元素;因五种短周期元素,原子序数依次增大,A、E同主族,故E是钠元素;C元素原子的电子层数为n,最外层电子数为2n+l,结合原子序数可知,符合条件的短周期元素只有氮元素;A、B、C、E每种元素都能与D元素组成两种或两种以上的常见化合物,D是氮元素与钠元素之间的元素,则符合的只有氧元素.
解答 解:A元素的原子半径最小,可知A是氢元素;B元素原子的最外层电子数是内层电子数的2倍,由于最外层电子数不超过8,原子只能有2个电子层,最外层电子数为4,故B是碳元素;因五种短周期元素,原子序数依次增大,A、E同主族,故E是钠元素;C元素原子的电子层数为n,最外层电子数为2n+l,结合原子序数可知,符合条件的短周期元素只有氮元素;A、B、C、E每种元素都能与D元素组成两种或两种以上的常见化合物,D是氮元素与钠元素之间的元素,则符合的只有氧元素.
(1)由上述分析可知,C为N元素,E为Na元素,故答案为:N;Na;
(2)A为H元素,C为N元素,二者形成的简单化合物为氨气,氨气为共价化合物,其电子式为: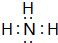 ,A为H、D为O元素,二者按原子数1:1形成的化合物为双氧水,其结构式为:H-O-O-H,
,A为H、D为O元素,二者按原子数1:1形成的化合物为双氧水,其结构式为:H-O-O-H,
故答案为: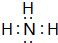 ;H-O-O-H;
;H-O-O-H;
(3)已知:①CH3OH(g)+H2O(g)=CO2(g)+3H2(g)△H=+49.0kJ/mol,
②CH3OH(g)+$\frac{1}{2}$O2(g)=CO2(g)+2H2(g)△H=-192.9kJ/mol,
根据盖斯定律,②×3-①×2可得:CH3OH(g)+$\frac{3}{2}$O2(g)=CO2(g)+2H2O(g)△H=-676.7KJ•mol-1 ;
燃料电池的负极发生氧化反应,甲醇在负极失去电子,在碱性条件下生成碳酸根离子,负极反应式为:CH3OH-6e-+8OH-=CO32-+6H2O,
故答案为:CH3OH(g)+$\frac{3}{2}$O2(g)=CO2(g)+2H2O(g)△H=-676.7KJ•mol-1 ;CH3OH-6e-+8OH-=CO32-+6H2O.
点评 本题考查位置结构与性质关系的综合应用,侧重对化学用语的考查,注意明确盖斯定律的含义,能够利用盖斯定律书写目标反应的热化学方程式,根据氧化还原反应判断原电池正负极发生的反应,注意电解质溶液酸碱性.

 名校通行证有效作业系列答案
名校通行证有效作业系列答案| A. | 浓硝酸保存在无色的玻璃瓶中 | |
| B. | 氯水应保存在带橡胶塞的棕色细口瓶中 | |
| C. | 金属钠应保存在汽油中防止被氧化 | |
| D. | 保存硫酸亚铁溶液时可向里面加少量铁屑 |

| A. | X显酸性 | B. | Y一定是水 | ||
| C. | Z可能是碳酸钠溶液 | D. | Z可使石蕊试液变蓝 |
| A. | S2-→HS- | B. | HCO3-→CO2 | C. | 2Cl-→Cl2 | D. | KClO3→KCl |
| A. | 40mL 1 mol•L-1的稀硝酸溶液 | B. | 40mL 0.5 mol•L-1的稀硫酸溶液 | ||
| C. | 40mL 1 mol•L-1的FeCl3溶液 | D. | 60mL 0.5 mol•L-1的稀盐酸 |
| A. | 强电解质在水溶液中的电离过程是不可逆的 | |
| B. | 强电解质的水溶液导电能力一定比弱电解质水溶液的导电能力强 | |
| C. | 易溶于水的电解质一定是强电解质 | |
| D. | 难溶于水的电解质一定是弱电解质 |
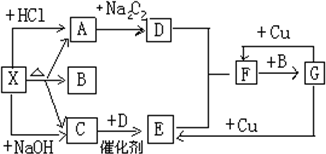 如图中的每一个方格表示有关的一种反应物或生成物,其中X为正盐,A能使澄清石灰水变浑浊的无色气体,C是能使湿润的红色的石蕊试纸变蓝的无色气体,
如图中的每一个方格表示有关的一种反应物或生成物,其中X为正盐,A能使澄清石灰水变浑浊的无色气体,C是能使湿润的红色的石蕊试纸变蓝的无色气体,