题目内容
6.下列变化过程中属于还原反应的是( )| A. | S2-→HS- | B. | HCO3-→CO2 | C. | 2Cl-→Cl2 | D. | KClO3→KCl |
分析 氧化还原反应中,氧化剂得到电子化合价降低被还原,发生还原反应;首先判断是否为氧化还原反应,然后根据元素化合价是否降低分析.
解答 解:A.S2-→HS-中元素化合价没有发生变化,不属于氧化还原反应,故A错误;
B.HCO3-→CO2中元素化合价没有发生变化,不属于氧化还原反应,故B错误;
C.2Cl-→Cl2中Cl元素化合价升高被氧化,属于氧化反应,故C错误;
D.KClO3→KCl中Cl元素化合价降低被还原,属于还原反应,故D正确;
故选D.
点评 本题考查氧化还原反应,为高考高频考点,把握反应中元素的化合价变化为解答的关键,侧重基本概念的考查,注意把握氧化剂发生还原反应,题目难度不大.

练习册系列答案
相关题目
16.能使石蕊试液变红,又能使酸性KMnO4试液变为无色澄清溶液,还能使溴水褪色的是( )
| A. | SO2 | B. | H2S | C. | Cl2 | D. | CO |
17. 有A、B两个完全相同的装置,某学生分别在它们的侧管中装入1.06g Na2CO3和0.84gNaHCO3,A、B中分别有10mL相同浓度的盐酸,将两个侧管中的物质同时倒入各自的试管中,下列叙述正确的是( )
有A、B两个完全相同的装置,某学生分别在它们的侧管中装入1.06g Na2CO3和0.84gNaHCO3,A、B中分别有10mL相同浓度的盐酸,将两个侧管中的物质同时倒入各自的试管中,下列叙述正确的是( )
 有A、B两个完全相同的装置,某学生分别在它们的侧管中装入1.06g Na2CO3和0.84gNaHCO3,A、B中分别有10mL相同浓度的盐酸,将两个侧管中的物质同时倒入各自的试管中,下列叙述正确的是( )
有A、B两个完全相同的装置,某学生分别在它们的侧管中装入1.06g Na2CO3和0.84gNaHCO3,A、B中分别有10mL相同浓度的盐酸,将两个侧管中的物质同时倒入各自的试管中,下列叙述正确的是( )| A. | A装置的气球膨胀速度比B快 | |
| B. | 若最终两气球体积相同,则盐酸的浓度一定大于或等于2 mol/L | |
| C. | 若最终两气球体积不同,则盐酸的浓度一定小于或等于1 mol/L | |
| D. | 最终两试管中Na+、Cl-的物质的量一定相同 |
14.下列各组物质按单质、氧化物、混合物的顺序排列的是( )
| A. | 冰、干冰、赤铁矿 | B. | 氢气、生石灰、煤 | ||
| C. | 红磷、纯碱、石油 | D. | 金刚石、熟石灰、空气 |
11.下列离子组能够大量共存的是( )
| A. | 无色溶液中:Cu2+、K+、NO3-、Cl- | |
| B. | 使pH试纸显红色的溶液中:Fe2+、K+、NO3-、Cl- | |
| C. | 含MnO4-的溶液中:Fe3+、SO42-、NO3-、Mg2+ | |
| D. | 与铝作用生成氢气的溶液中:Mg2+、NO3-、K+、Cl- |
18.下列离方程式书写正确的是( )
| A. | 石灰乳与Na2CO3溶液混合:Ca2++CO32-→CaCO3↓ | |
| B. | 酸性条件下KIO3溶液与KI溶液发生反应生成I2:IO3-+5I-+3H2O→3I2+6OH- | |
| C. | 向100mL0.1mol/L 的溴化亚铁溶液中通入0.05mol的氯气:2Fe2++4Br-+3Cl2→2 Fe3++2Br2+6Cl- | |
| D. | AgNO3溶液中加入过量的氨水:Ag++NH3•H2O→AgOH↓?+NH4+ |
15.如图所示为电化学降解NO3-.下列说法中正确的是( )


| A. | 铅蓄电池的A极为阴极 | |
| B. | 电解的过程中有H+从右池移动到左池 | |
| C. | 该电解池的阴极反应为:2NO3-+6H2O+12e-=N2↑+12OH- | |
| D. | 若电解过程中转移1moL电子,则交换膜两侧电解液的质量变化差为7.2g |
16.下列化学用语描述错误的是( )
| A. | H2O的电子式? | B. | Cl-的结构示意图 | ||
| C. | NH4Cl为离子化合物 | D. | 质量数为37的氯原子3717Cl |
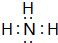 ,A和D按原子数1:1形成的化合物的结构式为H-O-O-H.
,A和D按原子数1:1形成的化合物的结构式为H-O-O-H.