题目内容
11.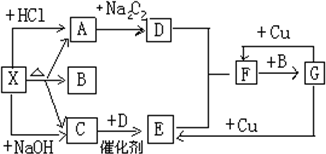 如图中的每一个方格表示有关的一种反应物或生成物,其中X为正盐,A能使澄清石灰水变浑浊的无色气体,C是能使湿润的红色的石蕊试纸变蓝的无色气体,
如图中的每一个方格表示有关的一种反应物或生成物,其中X为正盐,A能使澄清石灰水变浑浊的无色气体,C是能使湿润的红色的石蕊试纸变蓝的无色气体,请回答:
(1)物质X是(NH4)2CO3(写化学式,下同),A是CO2,B是H2O.
(2)写出反应的化学方程式
C→E:4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O
F→G:3NO2+H2O=2HNO3+NO
G→E:3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O.
分析 X既能与盐酸反应生成气体A,又能与NaOH反应生成气体C,C能使湿润的红色石蕊试纸变蓝,则C为NH3,X为弱酸铵盐,而A是能使澄清石灰水变浑浊的无色气体,且能与过氧化钠反应生成D,D能与氨气反应生成连续反应生成F,结合转化关系可知,A为CO2,D为O2,E为NO,F为NO2,B为H2O,G为HNO3,由于X为正盐,故X为(NH4)2CO3.
解答 解:X既能与盐酸反应生成气体A,又能与NaOH反应生成气体C,C能使湿润的红色石蕊试纸变蓝,则C为NH3,X为弱酸铵盐,而A是能使澄清石灰水变浑浊的无色气体,且能与过氧化钠反应生成D,D能与氨气反应生成连续反应生成F,结合转化关系可知,A为CO2,D为O2,E为NO,F为NO2,B为H2O,G为HNO3,由于X为正盐,故X为(NH4)2CO3.
(1)由上述分析可知,物质X是(NH4)2CO3,A是CO2,B是H2O,
故答案为:(NH4)2CO3;CO2;H2O;
(2)C→E的化学方程式为:4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O,
F→G的化学方程式为:3NO2+H2O=2HNO3+NO,
G→E的化学方程式为:3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O,
故答案为:4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O;3NO2+H2O=2HNO3+NO;3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O.
点评 本题考查无机物推断,“常温下A、C为无色气体,C能使湿润的红色石蕊试纸变蓝,X能与盐酸、氢氧化钠反应”等是推断突破口,需要学生熟练掌握元素化合物性质,掌握中学常见连续反应,难度中等.

练习册系列答案
 提分百分百检测卷系列答案
提分百分百检测卷系列答案 宝贝计划期末冲刺夺100分系列答案
宝贝计划期末冲刺夺100分系列答案 能考试全能100分系列答案
能考试全能100分系列答案
相关题目
6.铅蓄电池是常见的二次电池,目前汽车上使用的电瓶大多数是铅蓄电池.已知铅蓄电池的电解质溶液为硫酸溶液,其充、放电按下式进行:Pb(s)+PbO2(s)+2H2SO4(aq)$?_{充电}^{放电}$2PbSO4(s)+2H2O(1),下列有关该电池的说法正确的是( )
| A. | 放电时,溶液中H+向PbO2电极迁移 | |
| B. | 放电时,电路中转移0.2mol电子时Pb电极质量减小20.7g | |
| C. | 充电时,电解质溶液的pH增大 | |
| D. | 充电时,阴极的电极反应式为:PbSO4+2H2O-2e-=PbO2+4H++SO42- |
2.下列各组物质熔化或升华时,所克服的粒子间作用属于同种类型的是( )
| A. | MgO和SiC | B. | Fe和S | C. | CO2 和SiO2 | D. | 碘和干冰升华 |
6.下列说法中正确的是( )
| A. | 分子中键能越大,键长越长,则分子越稳定 | |
| B. | 元素周期表中的第ⅠA族(除H外)和第ⅦA族元素的原子间可能形成共价键 | |
| C. | 水分子可表示为H-O-H,分子中键角为180° | |
| D. | H-O键键能为463 kJ•mol-1,即18 g H2O分解成H2和O2时,消耗能量为2×463 kJ |
16.能使石蕊试液变红,又能使酸性KMnO4试液变为无色澄清溶液,还能使溴水褪色的是( )
| A. | SO2 | B. | H2S | C. | Cl2 | D. | CO |
3.我国成功研制的铯(133Cs)原子钟,使我国时间频率基准的精度从30万年不差1秒提高到600万年不差1秒.已知该铯原子的核外电子数为55,则该原子的中子数和质子数之差为( )
| A. | 23 | B. | 55 | C. | 78 | D. | 133 |
20.阅读如表中的部分短周期主族元素的相关信息
请回答下列问题:
(1)描述 Z 元素在周期表中的位置第三周期第ⅦA 族:
(2)T、X、Y 元素简单离子半径由大到小的顺序为:O2->Na+>Al3+(填离子符号)
(3)已知 1mol 化合物 A 与 Na2SO3在溶液中发生反应时,转移 2mol 电子,写出该反应的离子方程式ClO-+SO32-=Cl-+SO42-.
(4)第三周期元素的气态原子失去最外层一个电子所需能量(设为E)如图所示:

①同周期内,随着原子序数的增大,E值变化的总趋势是随着原子序数的递增,E 值增大.
②根据如图提供的信息,试推断E氟>E氧(填“>”“<”或“=”).
| 元素代号 | 相关信息 |
| T | T 的单质能与冷水剧烈反应,所得强碱性溶液中含有两种电子数相同的阴、阳离子 |
| X | X 的原子最外层电子数是其内层电子数的三倍 |
| Y | 在第三周期金属元素中,Y 的简单离子半径最小 |
| Z | T、X、Z 组成的 36 电子的化合物 A 是家用消毒剂的主要成分 |
(1)描述 Z 元素在周期表中的位置第三周期第ⅦA 族:
(2)T、X、Y 元素简单离子半径由大到小的顺序为:O2->Na+>Al3+(填离子符号)
(3)已知 1mol 化合物 A 与 Na2SO3在溶液中发生反应时,转移 2mol 电子,写出该反应的离子方程式ClO-+SO32-=Cl-+SO42-.
(4)第三周期元素的气态原子失去最外层一个电子所需能量(设为E)如图所示:

①同周期内,随着原子序数的增大,E值变化的总趋势是随着原子序数的递增,E 值增大.
②根据如图提供的信息,试推断E氟>E氧(填“>”“<”或“=”).

 ,A和D按原子数1:1形成的化合物的结构式为H-O-O-H.
,A和D按原子数1:1形成的化合物的结构式为H-O-O-H.