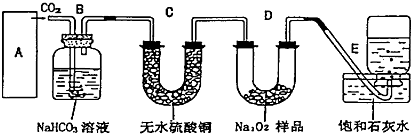
题目内容
9.氢是一种重要的非金属元素.氢的单质及其化合物在科学研究和工业生产中有着广泛而重要的作用.(1)NaH是一种生氢剂,能与水反应放出H2.NaH的电子式为
 ,NaH与H2O反应的化学方程式为NaH+H2O═NaOH+H2↑.
,NaH与H2O反应的化学方程式为NaH+H2O═NaOH+H2↑.(2)N2、O2和H2相互之间可以发生化合反应,已知反应的热化学方程式如下:
N2(g)+O2(g)=2NO(g)△H=+80.5kJ•mol-1;
2H2(g)+O2(g)=2H2O(g)△H=-483.6kJ•mol-1;
N2(g)+3H2(g)=2NH3(g)△H=-92.4kJ•mol-1.
则4NH3(g)+5O2(g)=4NO(g)+6H2O(g)△H=-1105kJ/mol.
(3)在一定条件下,用H2将二氧化碳转化为甲烷的反应如下:CO2(g)+4H2(g)?CH4(g)+2H2O(g)
①该反应的平衡常数表达式K=$\frac{c(C{H}_{4}){c}^{2}({H}_{2}O)}{c(C{O}_{2}){c}^{4}({H}_{2})}$.
②向一容积为2L的恒容密闭容器中充人一定量的CO2和H2,在300℃时发生上述反应,达到平衡时各物质的物质的量分别为CO2 0.4mol,H2 1.6mol,CH4 1.6mol,H2O 3.2mol.则CO2的平衡转化率为80%.若在200℃时该反应的平衡常数K=64.8,则该反应的△H<0(填“>’’或“<”).
(4)某研究小组以H2与CaCl2制备某种钙的化合物.已知反应只生成甲、乙两种化合物.对产物分析发现:化合物甲的组成中钙、氯元素的质量分数分别为52.29%、46.41%,化合物乙的水溶液显酸性.请回答下列问题:(相对原子质量Ca:40,Cl:35.5,H:1)
①甲的化学式为CaHCl.
②乙的浓溶液与酸性高锰酸钾反应可得Cl2,其反应的离子方程式为2MnO4-+10Cl-+16H+═2Mn2++5Cl2+8H2O.
分析 (1)NaH是钠离子和氢阴离子构成的离子化合物,据此书写电子式,NaH与H2O反应是氢元素间发生的归中反应生成氢气;
(2)已知:①N2(g)+O2(g)=2NO(g)△H=+80.5kJ•mol-1;
②2H2(g)+O2(g)=2H2O(g)△H=-483.6kJ•mol-1;
③N2(g)+3H2(g)=2NH3(g)△H=-92.4kJ•mol-1.
根据盖斯定律,②×3+①×2-③×2可得:4NH3(g)+5O2(g)=4NO(g)+6H2O(g);
(3)①平衡常数K=$\frac{生成物平衡浓度幂次方乘积}{反应物平衡浓度幂次方乘积}$;
②依据化学平衡三段式列式计算,转化率=$\frac{消耗量}{起始量}$×100%,计算此温度时的平衡常数,和在200℃时该反应的平衡常数K=64.8比较判断平衡进行的方向得到反应的能量变化;
(4)①化合物甲的组成中钙、氯元素的质量分数分别为52.29%、46.41%,还有一种元素,根据反应中元素守恒知,另一种元素为氢元素,则其钙原子、氯原子和氢原子个数之比=$\frac{52.29%}{40}$:$\frac{46.41%}{35.5}$:$\frac{1-52.29%-46.41%}{1}$=1:1:1,甲的化学式为CaHCl;
②化合物乙的水溶液显酸性,则为氯化氢,在高锰酸钾溶液中被氧化为氯气,高锰酸钾被还原为锰离子,结合电荷守恒、原子守恒配平书写离子方程式.
解答 解:(1)NaH是钠离子和氢阴离子构成的离子化合物,据此书写电子式为: ,NaH与H2O反应是氢元素间发生的归中反应生成氢气,反应的化学方程式为:NaH+H2O═NaOH+H2↑,
,NaH与H2O反应是氢元素间发生的归中反应生成氢气,反应的化学方程式为:NaH+H2O═NaOH+H2↑,
故答案为: ;NaH+H2O═NaOH+H2↑;
;NaH+H2O═NaOH+H2↑;
(2)已知:①N2(g)+O2(g)=2NO(g)△H=+80.5kJ•mol-1;
②2H2(g)+O2(g)=2H2O(g)△H=-483.6kJ•mol-1;
③N2(g)+3H2(g)=2NH3(g)△H=-92.4kJ•mol-1.
根据盖斯定律,②×3+①×2-③×2可得:4NH3(g)+5O2(g)=4NO(g)+6H2O(g)△H=-1105kJ/mol,
故答案为:-1105kJ/mol;
(3)①CO2(g)+4H2(g)?CH4(g)+2H2O(g)
该反应的平衡常数表达式K=$\frac{c(C{H}_{4}){c}^{2}({H}_{2}O)}{c(C{O}_{2}){c}^{4}({H}_{2})}$,
故答案为:$\frac{c(C{H}_{4}){c}^{2}({H}_{2}O)}{c(C{O}_{2}){c}^{4}({H}_{2})}$;
②向一容积为2L的恒容密闭容器中充人一定量的CO2和H2,在300℃时发生上述反应,达到平衡时各物质的物质的量分别为CO2 0.4mol,H2 1.6mol,CH4 1.6mol,H2O 3.2mol.依据化学三行计算得到:
CO2(g)+4H2(g)?CH4(g)+2H2O(g)
起始量(mol/L) 1 4 0 0
变化量(mol/L)0.8 3.2 0.8 1.6
平衡量(mol/L) 0.2 0.8 0.8 1.6
则CO2的平衡转化率=$\frac{0.8mol/L}{1mol/L}$×100%=80%
在300℃时平衡常数K=$\frac{1.{6}^{2}×0.8}{0.2×0.{8}^{4}}$=25
若在200℃时该反应的平衡常数K=64.8>25,则升温平衡常数减小,说明平衡正反应为放热反应,则该反应的△H<0,
故答案为:80%,<;
(4)①化合物甲的组成中钙、氯元素的质量分数分别为52.29%、46.41%,还有一种元素,根据反应中元素守恒知,另一种元素为氢元素,则其钙原子、氯原子和氢原子个数之比=$\frac{52.29%}{40}$:$\frac{46.41%}{35.5}$:$\frac{1-52.29%-46.41%}{1}$=1:1:1,甲的化学式为CaHCl,化合物乙的水溶液显酸性,则为氯化氢,
故答案为:CaHCl;
②化合物乙的水溶液显酸性,则为氯化氢,与酸性高锰酸钾反应可得Cl2,反应的离子方程式为:2MnO4-+10Cl-+16H+═2Mn2++5Cl2+8H2O,
故答案为:2MnO4-+10Cl-+16H+═2Mn2++5Cl2+8H2O.
点评 本题考查了热化学方程式书写和盖斯定律计算应用、化学平衡常数计算、物质间的反应和性质、物质组成的计算判断等,明确物质的性质是解本题关键,性质决定用途,注意甲不仅含有氯元素、钙元素还有氢元素,为易错点,题目难度中等

 阅读快车系列答案
阅读快车系列答案| A. | 加热能减慢反应速率 | |
| B. | 增大压强能加快反应速率 | |
| C. | 反应达到平衡时,v(正反应)=v(逆反应)=0 | |
| D. | 反应达到平衡时,N2转化率为100% |
| A. | B和D、C和D组成的常见化合物中化学键的类型相同 | |
| B. | 同周期元素中D的最高价氧化物对应水化物的酸性最强 | |
| C. | 氢化物的热稳定性:HnB<HnD | |
| D. | 离子半径的大小顺序:rD>rB>rC>rA |
| A. | 铁与水蒸气在高温下的反应产物为Fe2O3和H2 | |
| B. | 一定量的Fe与稀HNO3反应生成的盐中一定只有Fe(NO3)3 | |
| C. | 证明溶液中含Fe2+不含Fe3+的方法是先加KSCN溶液,溶液不变红色,然后加入氯水溶液变红色 | |
| D. | 除去FeCl2溶液中的FeCl3杂质可以向溶液中加入Cu粉,然后过滤 |
 近年来,我国的雾霾问题引起政府和群众的高度关切,一般认为细颗粒物(即PM2.5,指直径小于或等于2.5微米的颗粒物)的指标与雾霾天气密切相关.与此同时,光化学烟雾也开始抬头,它是由非甲烷烃和NOx的排放引起的,严重时天空会出现彩色云雾,属于一种重污染现象.臭氧浓度升高是光化学烟雾形成的标志.请回答下列相关问题:
近年来,我国的雾霾问题引起政府和群众的高度关切,一般认为细颗粒物(即PM2.5,指直径小于或等于2.5微米的颗粒物)的指标与雾霾天气密切相关.与此同时,光化学烟雾也开始抬头,它是由非甲烷烃和NOx的排放引起的,严重时天空会出现彩色云雾,属于一种重污染现象.臭氧浓度升高是光化学烟雾形成的标志.请回答下列相关问题:(1)以下可能引起细颗粒物指标变高的是abdef(填序号).
a.燃煤取暖 b.大型交通设备 c.生活污水 d.火山喷发 e.局部战争 f.采矿业
(2)如图是某地光化学烟雾的日变化曲线:据图所示,上午8:00,非甲烷烃和NO出现峰值. 随后NO2约于10:00达峰值,其主要反应的方程式可能为2NO+O2=2NO2.8:00起,O3开始积累,并于13:00达峰值,O3积累与下列过程有关:O+O2→O3,该反应物中游离的氧原子主要是由反应:NO2=NO+O产生的.O3又使10:00前NO2的含量急剧增加,其化学方程式为O3+NO=NO2+O2.你认为该地光化学烟雾较严重的时间最可能为c(填序号).
a.8:00 b.10:00 c.15:00 d.20:00
(3)若25℃、101kPa下,气体的摩尔体积为24.5L/mol,此条件下向容器中充入一定量N2O4,当NO2与N2O4的平衡混合物密度为3.18g/L时,混合气体的平均摩尔质量为77.9g/mol,N2O4的分解率(即转化率)为53.1%.(计算结果均保留三位有效数字).
(4)NO、NO2、NH4+及NO2-等被称为活性氮物质,超量排放会引起环境问题.NH4+与NO2-可发生下列反应:NH4+(aq)+NO2-(aq)═N2(g)+2H2O(l)可加快该反应的措施为升温、增大反应物浓度.该反应的反应速率方程为ν=k•c(NH4+)x•c(NO2-)y,其中k为速率常数,在一定温度下,进行下列实验:
| 实验序号 | c(NH4+)/mol•L-1 | c(NO2-)/mol•L-1 | ν/mol•L-1•s-1 |
| 1 | 0.0100 | 0.200 | 5.4×10-7 |
| 2 | 0.0200 | 0.200 | 1.08×10-6 |
| 3 | 0.200 | 0.040 | 2.16×10-6 |
| 4 | 0.200 | 0.060 | 3.24×10-6 |