题目内容
14.下列有关铁及其化合物的说法中正确的是( )| A. | 铁与水蒸气在高温下的反应产物为Fe2O3和H2 | |
| B. | 一定量的Fe与稀HNO3反应生成的盐中一定只有Fe(NO3)3 | |
| C. | 证明溶液中含Fe2+不含Fe3+的方法是先加KSCN溶液,溶液不变红色,然后加入氯水溶液变红色 | |
| D. | 除去FeCl2溶液中的FeCl3杂质可以向溶液中加入Cu粉,然后过滤 |
分析 A.不符合反应客观事实;
B.铁与稀硝酸反应,硝酸过量反应生成硝酸铁,硝酸不足反应生成二价铁离子;
C.检验二价铁离子存在,应排除三价铁离子干扰,根据Fe3+的特征反应判断溶液不含Fe3+;然后加入氧化剂,如果含有Fe2+,Fe2+被氧化剂氧化成Fe3+溶液变成红色,以此证明Fe2+的存在;
D.除杂不能引入新的杂质.
解答 解:A.铁与水蒸气在高温下的反应产物为Fe3O4和H2,故A错误;
B.铁与稀硝酸反应,硝酸过量反应生成硝酸铁,硝酸不足反应生成二价铁离子,故B错误;
C.证明溶液中含Fe2+不含Fe3+的方法是先加KSCN溶液,溶液不变红色,说明不含有三价铁离子,然后加入氯水溶液变红色,说明生成三价铁离子,溶液中含有二价铁离子,故C正确;
D.除去FeCl2溶液中的FeCl3杂质可以向溶液中加入Cu粉,反应生成氯化亚铁和氯化铜,除去三价铁离子,又引入铜离子,故D错误;
故选C.
点评 本题考查了铁与水蒸气的反应,二价铁离子的检验,熟悉不同价态铁元素之间的转化,明确除杂原则是解题关键,题目难度不大.

练习册系列答案
 新题型全程检测期末冲刺100分系列答案
新题型全程检测期末冲刺100分系列答案
相关题目
4.下列说法正确的是( )
| A. | 按系统命名法,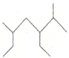 的名称为2-甲基-3,5-二乙基己烷 的名称为2-甲基-3,5-二乙基己烷 | |
| B. | 用Na2C03溶液能区分CH3CO0H、CH3CH2OH、苯和硝基苯四种物质 | |
| C. | 等质量的甲烷、乙烯、1,3一丁二烯分别充分燃烧,所消耗氧气的量依次增加 | |
| D. | 葡萄糖、蔗糖、油脂和蛋白质在一定条件下都能水解 |
5.下列化学物质的用途不正确的是( )
| A. | Na2O常用于潜水艇或呼吸面具的供氧剂 | |
| B. | 氧化镁用作耐火材料 | |
| C. | 利用NaHCO3治疗胃酸过多 | |
| D. | FeCl3溶液可用于刻制印刷铜电路板 |
2.用NA表示阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 标准状况下,22.4LCCl4含有NA个分子 | |
| B. | 0.2 mol•L-1 Na2S溶液中含有的S2-数目小于0.2NA | |
| C. | 18gD2O中含有的质子数为10NA(相对原子质量D:2,O:16) | |
| D. | 1molNa与足量的O2反应,钠失去NA个电子 |
19.下列离子的检验方法合理的是( )
| A. | 向某溶液中滴入KSCN溶液呈红色,说明不含Fe2+ | |
| B. | 向某溶液中加入酸性KMnO4溶液,溶液褪色,说明原溶液中一定含Fe2+ | |
| C. | 向某溶液中加入NaOH溶液,得红褐色沉淀,说明溶液中含有Fe3+ | |
| D. | 向某溶液中加入NaOH溶液得白色沉淀,又观察到颜色逐渐变为红褐色,说明该溶液中含有Fe2+,可能含有Mg2+ |
3.如图所示,装置在常温下工作(溶液体积变化忽略不计).闭合K,灯泡发光.下列叙述中不正确的是( )
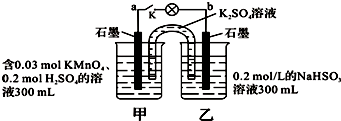

| A. | 当电路中有1.204×1022个电子转移时,乙烧杯中溶液的C(H+)约为0.1 mol•L-1 | |
| B. | 电池工作时,盐桥中的K+移向甲烧杯 | |
| C. | 电池工作时,外电路的电子方向是从a到b | |
| D. | 乙池中的氧化产物为SO42- |
4.分子式为C5H12O的链状有机物,能与金属钠反应且只两个甲基的同分异构体共有(不考虑立体异构)( )
| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |
 ,NaH与H2O反应的化学方程式为NaH+H2O═NaOH+H2↑.
,NaH与H2O反应的化学方程式为NaH+H2O═NaOH+H2↑.