题目内容
6.两种金属混合物粉末16g,与足量的盐酸反应时生成标准状况下11.2L氢气,符合上述情况的金属混合物是( )| A. | Mg,Fe | B. | Zn,Ag | C. | Fe,Zn | D. | Mg,Al |
分析 选项中若金属与盐酸反应,且盐酸足量,生成气体的物质的量为$\frac{11.2L}{22.4L/mol}$=0.5mol,若为+2价金属,则存在M~H2↑,可知金属的平均摩尔质量为$\frac{16g}{0.5mol}$=32g/mol,结合金属的相对原子质量来解答.
解答 解:选项中金属与盐酸反应,且盐酸足量,生成气体的物质的量为$\frac{11.2L}{22.4L/mol}$=0.5mol,若为+2价金属,则存在M~H2↑,可知金属的平均摩尔质量为$\frac{16g}{0.5mol}$=32g/mol,
A.Mg的相对原子质量为24,Fe的相对原子质量为56,平均摩尔质量可能为32g/mol,故A选;
B.Zn的相对原子质量为65,Ag与盐酸不反应,不符合,故B不选;
C.Zn的相对原子质量为65,Fe的相对原子质量为56,平均摩尔质量一定大于32g/mol,故C不选;
D.Mg的相对原子质量为24,Al转化为+2价时的相对原子质量为18,平均摩尔质量一定小于32g/mol,故D不选;
故选A.
点评 本题考查混合物的计算,为高频考点,把握金属与酸的反应、平均摩尔质量的应用为解答的关键,侧重分析与计算能力的考查,注意平均值法的应用,题目难度不大.

练习册系列答案
相关题目
16.某元素R原子的质量数为A,它的离子Rn-核外共有x个电子,则该元素的原子核内的中子数为( )
| A. | A-x | B. | A+n-x | C. | A-n-x | D. | A+n+x |
17.下列图示与对应的叙述相符合的是( )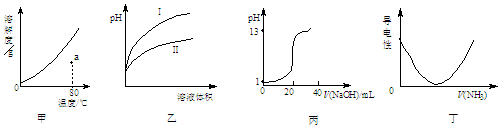

| A. | 图甲表示KNO3的溶解度曲线,a点所示溶液是80℃时KNO3的不饱和溶液 | |
| B. | 图乙表示用水稀释pH相同的盐酸和醋酸,I表示醋酸,II表示盐酸 | |
| C. | 图丙表示0.1000 mol•L-1NaOH溶液滴定20.00 mL 0.1000 mol•L-1CH3COOH溶液所得到的滴定曲线 | |
| D. | 图丁表示将NH3通入醋酸溶液的过程中,溶液导电性的变化 |
14.下列说法正确的是( )
| A. | 加入过量氨水,有白色沉淀生成,则原溶液一定有Al3+ | |
| B. | 加入KSCN溶液,溶液变红,则原溶液一定有Fe2+ | |
| C. | 加入盐酸酸化的BaCl2溶液,有白色沉淀生成,则原溶液一定有SO42- | |
| D. | 加入NaOH溶液,产生气体使湿润的红色石蕊试纸变蓝,则原溶液一定有NH4+ |
1.已知某温度下可逆反应:M(g)+N(g)?P(g)+Q(g),反应物的初始浓度分别为:c0(M)=1mol•L-1,c0(N)=2.4mol•L-1;达到平衡后,M的平衡转化率为60%,则此时平衡常数K的数值为( )
| A. | 0.5 | B. | 1 | C. | 0.25 | D. | 2 |
18.设NA表示阿伏加德罗常数,下列说法中正确的是( )
| A. | NA个N2分子和NA个CO分子质量比为1:2 | |
| B. | 1 mol H2O的质量等于NA个H2O质量的总和 | |
| C. | 在任何条件下1mol H2所含的原子数为NA | |
| D. | 1mol H2SO4中所含的粒子数目一定是NA |
15.NA为阿伏伽德罗常数的值.下列说法正确的是( )
| A. | 1 mol FeCl3水解生成的 Fe(OH)3胶粒数为 lNA | |
| B. | 将 lmol Cl2通人水中,HC1O、Cl、C1O 粒子数之和为 2NA | |
| C. | 1 mol Fe 溶于过量硝酸,电子转移数为 2NA | |
| D. | 10℃时,lL pH=1.0 的 H2SO4溶液中含 H+为 0.1NA |
16. 如图是可逆反应A+2B?2C+3D的化学反应速率与化学平衡随外界条件改变(先降温后加压)而变化的情况,由此可推断( )
如图是可逆反应A+2B?2C+3D的化学反应速率与化学平衡随外界条件改变(先降温后加压)而变化的情况,由此可推断( )
 如图是可逆反应A+2B?2C+3D的化学反应速率与化学平衡随外界条件改变(先降温后加压)而变化的情况,由此可推断( )
如图是可逆反应A+2B?2C+3D的化学反应速率与化学平衡随外界条件改变(先降温后加压)而变化的情况,由此可推断( )| A. | 正反应是吸热反应 | |
| B. | 若A、B是气体,则D是液体或固体 | |
| C. | 若A、B是气体,则C、D中至少有一种不是气体 | |
| D. | A、B、C、D均为气体 |