题目内容
1.已知某温度下可逆反应:M(g)+N(g)?P(g)+Q(g),反应物的初始浓度分别为:c0(M)=1mol•L-1,c0(N)=2.4mol•L-1;达到平衡后,M的平衡转化率为60%,则此时平衡常数K的数值为( )| A. | 0.5 | B. | 1 | C. | 0.25 | D. | 2 |
分析 达到平衡后,M的平衡转化率为60%,则
M(g)+N(g)?P(g)+Q(g)
开始 1 2.4 0 0
转化 0.6 0.6 0.6 0.6
平衡 0.4 1.8 0.6 0.6
结合K为生成物浓度幂之积与反应物浓度幂之积的比计算.
解答 解:达到平衡后,M的平衡转化率为60%,则
M(g)+N(g)?P(g)+Q(g)
开始 1 2.4 0 0
转化 0.6 0.6 0.6 0.6
平衡 0.4 1.8 0.6 0.6
则此时平衡常数K=$\frac{0.6×0.6}{0.4×1.8}$=0.5,
故选A.
点评 本题考查化学平衡常数的计算,为高频考点,把握化学平衡三段法、K的计算为解答的关键,侧重分析与计算能力的考查,注意利用平衡浓度计算K,题目难度不大.

练习册系列答案
相关题目
11.下列有关HCl和HBr的叙述错误的是( )
| A. | 键能:HBr>HCl | B. | 键长:HBr>HCl | ||
| C. | 沸点:HBr>HCl | D. | 共用电子对偏向:HCl>HBr |
12.下列关于化石燃料的加工说法正确的( )
| A. | 石油裂化主要得到乙烯 | |
| B. | 石油分馏在分馏塔中进行,是化学变化,可得到汽油、煤油 | |
| C. | 煤干馏主要得到焦炭、煤焦油、粗氨水和焦炉气等 | |
| D. | 煤制煤气是物理变化,是高效、清洁地利用煤的重要途径 |
9.高聚物••--CH2-CH2-CH2-是用下列何种物质聚合而成的( )
| A. | CH3-CH3 | B. | CH3-CH2-CH3 | C. | CH2=CH-CH3 | D. | CH2=CH2 |
6.两种金属混合物粉末16g,与足量的盐酸反应时生成标准状况下11.2L氢气,符合上述情况的金属混合物是( )
| A. | Mg,Fe | B. | Zn,Ag | C. | Fe,Zn | D. | Mg,Al |
13.下列关于“剂”的说法正确的是( )
| A. | 卤制品中可添加亚硝酸盐作为增色剂 | |
| B. | 补血剂口服液中添加的维生素C作为氧化剂 | |
| C. | 中国古代用明矾溶液做铜镜表面铜锈的除锈剂 | |
| D. | 月饼包装盒内放有小袋铁粉主要作为干燥剂 |
10. 已知 25℃时部分弱电解质的电离平衡常数数据如表:
已知 25℃时部分弱电解质的电离平衡常数数据如表:
回答下列问题:
(1)写出碳酸的主要的电离方程式H2CO3?H++HCO3-.若将碳酸饱和溶液稀释 10 倍,则稀释后的溶液中 c(H+)大于原来的十分之一(填“大于”、“小于”或“等于”).
(2)物质的量浓度均为 0.1mol/L 的五种溶液:pH 由小到大的顺序为e<a<d<c<b(用编号填写).
a.CH3COONa b.Na2CO3 c.NaClO d.NaHCO3 e.NaSCN
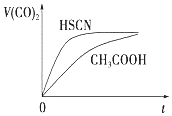
(3)25℃时,将 20mL0.1mol•L-1CH COOH 溶液和 20mL0.1mol•L-1HSCN 溶液分别与 20mL0.1mol•L-1NaHCO 溶液混合,实验测得产生的气体体积(V)随时间(t)的变化如图.反应初始阶段两种溶液产生 CO2气体的速率存在明显差异的原因是HSCN的酸性比CH3COOH强,其溶液中c(H+)较大,故其溶液与NaHCO3溶液的反应速率快反应结束后,假设 NaHCO3完全反应且气体全部逸出,则所得两溶液中,c(CH3COO)<c(SCN)(填“>”、“<”或“=”)
(4)25℃时,CH3COONa 与 CH3COOH 的混合溶液,若测得 pH=8,则溶液中c(Na+)-c(CH3COO-)=10-6-10-8mol/L(填代入数据后的计算式,不必算出具体数值).
(5)向 NaClO 溶液中通入少量的 CO2,发生反应的离子方程式为ClO-+CO2+H2O═HClO+HCO3-.
 已知 25℃时部分弱电解质的电离平衡常数数据如表:
已知 25℃时部分弱电解质的电离平衡常数数据如表:| 化学式 | HSCN | CH3COOH | H2CO3 | HClO |
| 电离平衡常数 | 1.3×10-1 | 1.8×10-5 | Ka1=4.3×10-1Ka2=5.6×10-1 | 3.0×10-8 |
(1)写出碳酸的主要的电离方程式H2CO3?H++HCO3-.若将碳酸饱和溶液稀释 10 倍,则稀释后的溶液中 c(H+)大于原来的十分之一(填“大于”、“小于”或“等于”).
(2)物质的量浓度均为 0.1mol/L 的五种溶液:pH 由小到大的顺序为e<a<d<c<b(用编号填写).
a.CH3COONa b.Na2CO3 c.NaClO d.NaHCO3 e.NaSCN
(3)25℃时,将 20mL0.1mol•L-1CH COOH 溶液和 20mL0.1mol•L-1HSCN 溶液分别与 20mL0.1mol•L-1NaHCO 溶液混合,实验测得产生的气体体积(V)随时间(t)的变化如图.反应初始阶段两种溶液产生 CO2气体的速率存在明显差异的原因是HSCN的酸性比CH3COOH强,其溶液中c(H+)较大,故其溶液与NaHCO3溶液的反应速率快反应结束后,假设 NaHCO3完全反应且气体全部逸出,则所得两溶液中,c(CH3COO)<c(SCN)(填“>”、“<”或“=”)
(4)25℃时,CH3COONa 与 CH3COOH 的混合溶液,若测得 pH=8,则溶液中c(Na+)-c(CH3COO-)=10-6-10-8mol/L(填代入数据后的计算式,不必算出具体数值).
(5)向 NaClO 溶液中通入少量的 CO2,发生反应的离子方程式为ClO-+CO2+H2O═HClO+HCO3-.
11.下列实验操作能达到实验目的是( )
| 实验目的 | 实验操作 | |
| A | 比较水和乙醇中氢的活泼性 | 分别讲少量钠投入到盛有水和乙醇的烧杯中 |
| B | 由MgCl2溶液制备无水MgCl2 | 将MgCl2溶液加热蒸干 |
| C | 除去Cu粉中混有的CuO | 加入稀硝酸溶液,过滤、洗涤、干燥 |
| D | 制备Fe(OH)3胶体 | 将NaOH浓溶液滴加到饱和的FeCl3溶液中 |
| A. | A | B. | B | C. | C | D. | D |