题目内容
14.下列说法正确的是( )| A. | 加入过量氨水,有白色沉淀生成,则原溶液一定有Al3+ | |
| B. | 加入KSCN溶液,溶液变红,则原溶液一定有Fe2+ | |
| C. | 加入盐酸酸化的BaCl2溶液,有白色沉淀生成,则原溶液一定有SO42- | |
| D. | 加入NaOH溶液,产生气体使湿润的红色石蕊试纸变蓝,则原溶液一定有NH4+ |
分析 A.白色沉淀可能为氢氧化铝、氢氧化镁等;
B.加入KSCN溶液,溶液变红,可知Fe3+与SCN-结合生成络离子;
C.白色沉淀可能为AgCl或硫酸钡;
D.氨气使湿润的红色石蕊试纸变蓝.
解答 解:A.白色沉淀可能为氢氧化铝、氢氧化镁等,则原溶液中可能含Al3+,故A错误;
B.加入KSCN溶液,溶液变红,可知Fe3+与SCN-结合生成络离子,则原溶液一定有Fe3+,故B错误;
C.白色沉淀可能为AgCl或硫酸钡,则原溶液可能含银离子或硫酸根离子,但二者不能同时存在,故C错误;
D.氨气使湿润的红色石蕊试纸变蓝,则原溶液一定有NH4+,故D正确;
故选D.
点评 本题考查常见离子的检验,为高频考点,把握试剂、现象、结论为解答的关键,侧重分析与实验能力的考查,注意排除干扰离子的影响,题目难度不大.

练习册系列答案
相关题目
4.下列有关实验的叙述正确的是( )
| A. | “萃取”实验中,振荡后,需要打开分液漏斗活塞,使漏斗内气体放出 | |
| B. | “浓硫酸稀释”实验中,将水慢慢注入浓硫酸中,并不断搅拌 | |
| C. | “实验室制取氢气”实验中,收集装置与氯气的收集装置相同 | |
| D. | “测定气体摩尔体积”实验中,若温度高于0℃,气体摩尔体积一定大于22.4L/mol |
5.化学知识在生产和生活中有着广泛的应用,下列说法中不正确的是( )
| A. | 氢能源的优点是热值高、无污染 | |
| B. | 与铜质水龙头连接处的铁质水管易发生锈蚀 | |
| C. | 放在冰箱电的食品保存时间较长,与温度对反应速率的影响有关 | |
| D. | 铅蓄电池放电时,电能转变为化学能 |
9.高聚物••--CH2-CH2-CH2-是用下列何种物质聚合而成的( )
| A. | CH3-CH3 | B. | CH3-CH2-CH3 | C. | CH2=CH-CH3 | D. | CH2=CH2 |
19.下列事实中,不能用平衡移动原理解释的是( )
| A. | 氯气中有下列平衡Cl2+H2O?HCl+HClO,当加入AgNO3(s)后溶液颜色变浅 | |
| B. | 2NO2(g)?N2O4(g)△H<0,升高温度可使体系颜色加深 | |
| C. | 反应CO+NO2?CO2+NO△H<0,升高温度可使平衡向逆反应方向移动 | |
| D. | 合成氨反应N2+3H2?2NH3△H<0,使用催化剂加快反应速率 |
6.两种金属混合物粉末16g,与足量的盐酸反应时生成标准状况下11.2L氢气,符合上述情况的金属混合物是( )
| A. | Mg,Fe | B. | Zn,Ag | C. | Fe,Zn | D. | Mg,Al |
3.已知 X2(g)+Y2 (g)?2Z(g),X2、Y2、Z 的起始浓度分别为 0,1mol•L-1、0.3mol•L-1,0.2mol•L-1.在一定条件下,当反应达到平衡时,各物质的浓度可能是( )
| A. | Z 为 0.4mol•L-1 | B. | X 为 0.2 mol•L-1 | ||
| C. | Y 为 0.4 mol•L-1 | D. | Z 为 0.3 mol•L-1 |
4.某有机物的结构如图所示,下列说法不正确的是( )
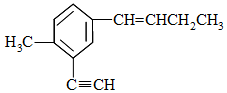

| A. | 与乙苯不互为同系物 | |
| B. | 分子中共直线的碳原子最多有4个 | |
| C. | 分子中共平面的原子最多有20个 | |
| D. | 与其互为同分异构体且萘环上只有一个侧链的共有4种 |
 在金属或非金属底物材料上,用NaBH4进行“化学镀”镀镍,可以得到坚硬、耐腐蚀的保护层(3Ni3B+Ni),反应的离子方程式为:20Ni2++16BH4-+34OH-+6H2O═2(3Ni3B+Ni)+10B(OH)4-+35H2↑
在金属或非金属底物材料上,用NaBH4进行“化学镀”镀镍,可以得到坚硬、耐腐蚀的保护层(3Ni3B+Ni),反应的离子方程式为:20Ni2++16BH4-+34OH-+6H2O═2(3Ni3B+Ni)+10B(OH)4-+35H2↑