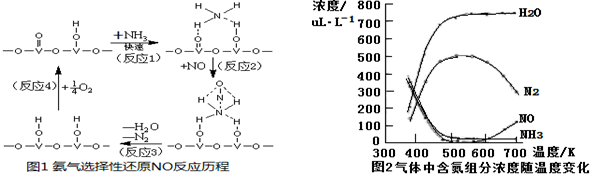
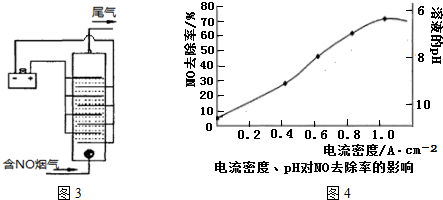
题目内容
2.已知苯甲酸微溶于水,易溶于乙醇、乙醚,有弱酸性,酸性比醋酸强.它可用于制备苯甲酸乙酯和苯甲酸铜.
(一)制备苯甲酸乙酯
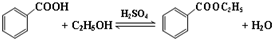
| 沸点(℃) | 密度(g•cm-3) | |
| 苯甲酸 | 249 | 1.2659 |
| 苯甲酸乙酯 | 212.6 | 1.05 |
| 乙醇 | 78.5 | 0.7893 |
| 环己烷 | 80.8 | 0.7785 |
| 乙醚 | 34.51 | 0.7318 |
| 环己烷、乙醇和水共沸物 | 62.1 |
实验流程如下:

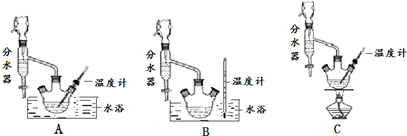
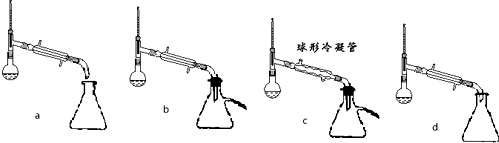
(1)制备苯甲酸乙酯,下列装置最合适的是B,带“分水器”的冷凝回流装置与一般的冷凝装置相比,主要优点在于分离出生成的水,促进酯化反应向正向进行
(2)步骤②控制温度在65~70℃缓慢加热液体回流,分水器中逐渐出现上、下两层液体,直到反应完成,停止加热.放出分水器中的下层液体后,继续加热,蒸出多余的乙醇和环己烷.反应完成的标志是分水器中下层(水层)液面不再升高
(3)步骤③碳酸钠的作用是中和苯甲酸和硫酸
(4)步骤④将中和后的液体转入分液漏斗分出有机层,水层用25mL乙醚萃取,然后合并至有机层,加入无水MgSO4.乙醚的作用是萃取出水层中溶解的苯甲酸乙酯,提高产率
(5)步骤⑤蒸馏操作中,下列装置最好的是bd(填标号),蒸馏时先低温蒸出乙醚,蒸馏乙醚时最好采用水浴加热(水浴加热、直接加热、油浴加热).
(二)制备苯甲酸铜
将苯甲酸加入到乙醇与水的混合溶剂中,充分溶解后,加入Cu(OH)2粉未,然后水浴加热,于70~80℃下保温2~3小时;趁热过滤,滤液蒸发冷却,析出苯甲酸铜晶体,过滤、洗涤、干燥得到成品.
(6)混合溶剂中乙醇的作用是增大苯乙酸的溶解度,便于充分反应,趁热过滤的原因为苯甲酸铜冷却后会结晶析出,如不趁热过滤会损失产品.
(7)洗涤苯甲酸铜晶体时,下列洗涤剂最合适的是C
A.冷水 B.热水 C.乙醇 D.乙醇水混合溶液.
分析 (1)根据步骤②控制温度在65~70℃缓慢加热液体回流,可判断选择水浴加热的方式,要控制水浴的温度,所以温度计应测量水的温度,故选B装置,由于水-乙醇-环己烷三元共沸物,可以带出生成的水,可使酯化反应正向进行;
(2)根据反应产物可知,当反应完成时,不再产生水,分水器中下层(水层)液面不再升高,据此判断;
(3)反应物中用了苯甲酸和硫酸,所以加入碳酸钠可以中和酸;
(4)苯甲酸乙酯中溶解有少量水,用乙醚可以将其萃取出来;
(5)根据防止产物挥发到空气和冷凝效果选择装置,乙醚的沸点较低,用水浴即可将其蒸出;
(6)苯甲酸微溶于水,使用乙醇可以增大苯甲酸的溶解度,便于充分反应;苯甲酸铜冷却后会结晶析出,所以要趁热过滤;
(7)洗涤苯甲酸铜晶体时,既要除去表面可溶性杂质,又要尽可能减小苯甲酸铜晶体的溶解,且便于干燥,据此选择洗涤的试剂
解答 解:(1)根据步骤②控制温度在65~70℃缓慢加热液体回流,可判断选择水浴加热的方式,要控制水浴的温度,所以温度计应测量水的温度,故选B装置,由于水-乙醇-环己烷三元共沸物,所以环己烷在本实验中的作用是可以带出生成的水,可使酯化反应正向进行,
故答案为:B;分离出生成的水,促进酯化反应向正向进行;
(2)根据反应产物可知,当反应完成时,不再产生水,分水器中下层(水层)液面不再升高,所以反应完成的标志是分水器中下层(水层)液面不再升高,
故答案为:分水器中下层(水层)液面不再升高;
(3)反应物中用了苯甲酸和硫酸,所以加入碳酸钠可以中和酸,
故答案为:中和苯甲酸和硫酸;加入过快大量泡沫的产生可使液体溢出;
(4)苯甲酸乙酯中溶解有少量水,用乙醚可以将其萃取出来,以提高产率,
故答案为:萃取出水层中溶解的苯甲酸乙酯,提高产率;
(5)根据防止产物挥发到空气和冷凝效果选择装置b或d都可以,乙醚的沸点较低,用水浴即可将其蒸出,
故答案为:bd;水浴加热;
(6)苯甲酸微溶于水,使用乙醇可以增大苯甲酸的溶解度,便于充分反应;苯甲酸铜冷却后会结晶析出,所以要趁热过滤,
故答案为:增大苯乙酸的溶解度,便于充分反应;苯甲酸铜冷却后会结晶析出,如不趁热过滤会损失产品;
(7)洗涤苯甲酸铜晶体时,既要除去表面可溶性杂质,又要尽可能减小苯甲酸铜晶体的溶解,且便于干燥,苯甲酸铜易溶于水,难溶于乙醇,
故选C.
点评 本题考查了物质制备方案的设计,题目难度中等,明确制备原理为解答关键,试题涉及酯化反应原理、化学实验基本操作方法、化学平衡的影响因素等知识,注意掌握物质制备方案的设计及评价原则,试题充分考查了学生的分析能力、理解能力及化学实验能力.

| A. | 可用丁达尔效应区分溶液和胶体 | |
| B. | 将1.0molFeCl3全部制成胶体,其中氢氧化铁胶粒为NA个 | |
| C. | Fe(OH)3胶体的电泳实验说明了胶体粒子带有电荷 | |
| D. | 江河入海口三角洲的形成,通常与胶体的性质有关 |
| A. | 左盘高 | B. | 右盘高 | C. | 仍保持平衡 | D. | 不能确定 |
| A. | D的浓度减小了 | B. | A的转化率减小了 | ||
| C. | 物质B的质量分数增加了 | D. | a+b>c+d |
| MnO2 | 触摸试管情况 | 观察结果 | 反应完成所需的时间 |
| 粉末状 | 很烫 | 剧烈反应,带火星的木条复燃 | 3.5min |
| 块状 | 微热 | 反应较慢,火星红亮但木条未复燃 | 30min |
(2)实验结果表明,催化剂的催化效果与催化剂的颗粒大小有关.
Ⅱ.研究知Cu2+对H2O2分解也具有催化作用,为比较Fe3+和Cu2+对H2O2分解的催化效果,某研究小组的同学分别设计了如图甲、乙所示的实验.回答相关问题:
(3)定性分析:如图甲可通过观察产生气泡的快慢,定性比较得出结论.有同学提出将FeCl3改为Fe2(SO4)3更为合理,其理由是控制阴离子相同,排除阴离子的干扰.
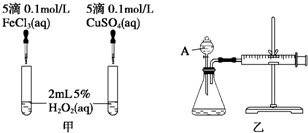
(4)定量分析:如图乙所示,实验时均以生成40mL气体为准,其他可能影响实验的因素均已忽略.图中仪器A的名称为分液漏斗,实验中需要测量的数据是收集40 mL气体所需要的时间.
| A. | 分子式为C2H4O2的有机物不一定有酸性 | |
| B. | 当物质中的化学键发生断裂时,一定发生化学变化 | |
| C. | 等质量的Al分别按a、b两种途径完全转化,途径a比途径b产生的H2多 途径a:Al$\stackrel{HCl}{→}$H2 途径b:Al$\stackrel{Fe_{2}O_{3}}{→}$Fe$\stackrel{HCl}{→}$H2 | |
| D. | 只由一种元素的阳离子与另一种元素的阴离子组成的物质不一定是纯净物 |
| A. | 按系统命名法,化合物 的名称为:2,6-二甲基-5-乙基庚烷 的名称为:2,6-二甲基-5-乙基庚烷 | |
| B. | 丙氨酸和苯丙氨酸脱水,最多可生成3种二肽 | |
| C. | 大气污染物氟利昂-12的化学式是CF2Cl2具有正四面体结构 | |
| D. | 三硝酸甘油酯的分子式为C3H5N3O9 |
 利用如图装置,可以在室温和一个标准大气压条件下测定镁的相对原子质量.
利用如图装置,可以在室温和一个标准大气压条件下测定镁的相对原子质量.