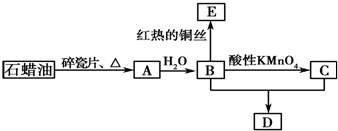
题目内容
5.1克氢气燃烧生成液态水放出142.9kJ热,该反应的热化学方程式正确的是( )| A. | 2H2(g)+O2(g)=2H2O(l);△H=-142.9 kJ•mol-1 | |
| B. | H2(g)+$\frac{1}{2}$O2(g)=H2O(l);△H=-285.8 kJ•mol-1 | |
| C. | 2H2+O2=2H2O;△H=-571.6 kJ•mol-1 | |
| D. | H2(g)+$\frac{1}{2}$O2(g)=H2O(g);△H=-285.8 kJ•mol-1 |
分析 根据m=nM计算出1mol氢气的质量,再计算出1mol氢气完全燃烧生成液态水放出热量,从而可写出氢气燃烧的热化学方程式;最后根据热化学方程式的书写原则对各选项进行判断.
解答 解:1mol氢气的质量为:2g/mol×1mol=2g,则2g氢气燃烧生成液态水放出的热量为:142.9kJ×$\frac{2g}{1g}$=285.8kJ,则氢气燃烧的热化学方程式为:H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H=-285.8 kJ•mol-1,
A.焓变与化学计量数成正比,则2mol氢气放出的热量为285.8kJ×2=571.6kJ,正确的热化学方程式为:2H2(g)+O2(g)=2H2O(l)△H=-571.6 kJ•mol-1,故A错误;
B.根据分析可知,氢气燃烧的热化学方程式为:H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H=-285.8 kJ•mol-1,故B正确;
C.热化学方程式中必须注明各物质的状态,故C错误;
D.生成水的状态应该为气态,正确的热化学方程式为:H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H=-285.8 kJ•mol-1,故D错误;
故选B.
点评 本题考查了热化学方程式的书写方法,题目难度不大,明确热化学方程式的书写原则为解答关键,试题侧重基础知识的考查,有利于提高学生的分析能力及灵活应用能力.

练习册系列答案
相关题目
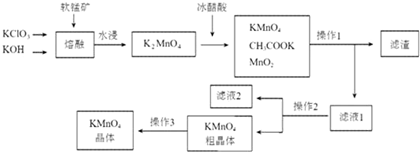
15.高锰酸钾是一种常用的氧化剂.下图是利用软锰矿(主要成分为MnO2)制备高锰酸钾的一种工艺(流程中部分产物已略去):
相关物质不同温度下的溶解度(单位:g)数据如表:
(1)“熔融”步骤反应的化学方程式为3MnO2+KClO3+6KOH$\frac{\underline{\;熔融\;}}{\;}$3K2MnO4+KCl+3H2O.
(2)K2MnO4溶液中加入冰醋酸发生反应的离子方程式为:3MnO42-+4CH3COOH=2MnO4-+MnO2↓+2H2O+4CH3COO-.
(3)操作2是蒸发浓缩、冷却结晶、过滤.
(4)图中可以直接进行循环利用的物质是(填化学式)MnO2.
(5)KMnO4粗晶体中的主要杂质(填化学式)有KCl和CH3COOK;操作3用到的试剂蒸馏水和硝酸银溶液;若用硫酸代替图中的冰醋酸,则导致的问题及原因是反应生成K2SO4,而K2SO4在常温下的溶解度也较小,析出后从而导致产品的纯度降低或硫酸酸性太强,导致MnO4-将Cl-氧化,产生有毒的Cl2,KMnO4损失且纯度降低.

相关物质不同温度下的溶解度(单位:g)数据如表:
| 物质 温度 | KMnO4 | CH3COOK | K2SO4 | KCl |
| 20℃ | 6.34 | 217 | 11.1 | 34.2 |
| 90℃ | 45.2 | 398 | 22.9 | 53.9 |
(2)K2MnO4溶液中加入冰醋酸发生反应的离子方程式为:3MnO42-+4CH3COOH=2MnO4-+MnO2↓+2H2O+4CH3COO-.
(3)操作2是蒸发浓缩、冷却结晶、过滤.
(4)图中可以直接进行循环利用的物质是(填化学式)MnO2.
(5)KMnO4粗晶体中的主要杂质(填化学式)有KCl和CH3COOK;操作3用到的试剂蒸馏水和硝酸银溶液;若用硫酸代替图中的冰醋酸,则导致的问题及原因是反应生成K2SO4,而K2SO4在常温下的溶解度也较小,析出后从而导致产品的纯度降低或硫酸酸性太强,导致MnO4-将Cl-氧化,产生有毒的Cl2,KMnO4损失且纯度降低.
16.下列关于乙烯、乙炔和乙烷的说法,不正确的是( )
| A. | 乙烯和乙炔属于不饱和烃,乙烷属于饱和烃 | |
| B. | 乙烯和乙炔分子中所有原子都在同一平面上,乙烷分子中所有原子不都在同一平面上 | |
| C. | 乙烯和乙炔都能发生加成反应,乙烷不能发生加成反应 | |
| D. | 在发生加成反应时,乙烯和乙炔分子中的碳碳键全部断裂 |
10.对A、B、C三种金属活动性的实验研究过程如下:
(1)取大小相等的三种金属片,分别放入CuSO4溶液中,一段时间后,A、C表面出现红色物质,B表面没有现象.
(2)取大小相等的A、C两种金属片,分别放入相同的稀盐酸中,A、C表面都产生气泡,但A产生气泡的速度明显比C的快.
则A、B、C三种金属的活动性顺序是( )
(1)取大小相等的三种金属片,分别放入CuSO4溶液中,一段时间后,A、C表面出现红色物质,B表面没有现象.
(2)取大小相等的A、C两种金属片,分别放入相同的稀盐酸中,A、C表面都产生气泡,但A产生气泡的速度明显比C的快.
则A、B、C三种金属的活动性顺序是( )
| A. | A>C>B | B. | C>A>B | C. | C>B>A | D. | A>B>C |
17.下列物质的变化所破坏的作用力相同的是( )
| A. | NaCl和HCl溶于水都电离成离子 | B. | SiO2和冰块的熔化 | ||
| C. | 晶体硫的熔化和晶体碘的升华 | D. | 酒精和冰醋酸溶于水 |
15.医院给病人输氧时用到类似下图所示的装置.关于该装置,下列说法不正确的是( )


| A. | b导管连接供给氧气的钢瓶 | |
| B. | b导管连接病人吸氧气的塑料管 | |
| C. | 使用该装置用来观测是否有氧气输出 | |
| D. | 使用该装置用来观测氧气输出的速率 |