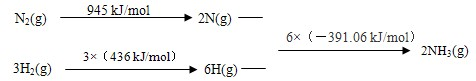题目内容
下列分子或离子在指定的分散系中能大量共存的一组是( )
| A、使酚酞变红色的溶液:Na+、Ba2+、Cl-、NO3- |
| B、空气:C2H6、CO2、SO2、NO |
| C、氯化铁溶液:H+、K+、NO3-、I- |
| D、高锰酸钾溶液:H+、Na+、SO42-、葡萄糖分子 |
考点:离子方程式的书写
专题:离子反应专题
分析:A.使酚酞变红色的溶液,溶液呈碱性;
B.NO具有强的还原性,容易被空气中的氧气氧化;
C.三价铁离子、NO3-(H+)具有强的氧化性,I-具有强的还原性;
D.葡萄糖分子含有醛基,具有还原性,酸性的高锰酸钾溶液具有强的氧化性.
B.NO具有强的还原性,容易被空气中的氧气氧化;
C.三价铁离子、NO3-(H+)具有强的氧化性,I-具有强的还原性;
D.葡萄糖分子含有醛基,具有还原性,酸性的高锰酸钾溶液具有强的氧化性.
解答:
解:A.Na+、Ba2+、Cl-、NO3-四种离子在碱性环境下不发生反应,能大量共存,故A正确;
B.空气中的氧气能够氧化NO生成二氧化氮,故B错误;
C.三价铁离子、NO3-(H+)具有强的氧化性,I-具有强的还原性,发生氧化还原反应,不共存,故C错误;
D.葡萄糖分子含有醛基,具有还原性,酸性的高锰酸钾溶液具有强的氧化性,二者不共存,故D错误;
故选:A.
B.空气中的氧气能够氧化NO生成二氧化氮,故B错误;
C.三价铁离子、NO3-(H+)具有强的氧化性,I-具有强的还原性,发生氧化还原反应,不共存,故C错误;
D.葡萄糖分子含有醛基,具有还原性,酸性的高锰酸钾溶液具有强的氧化性,二者不共存,故D错误;
故选:A.
点评:本题考查了物质的共存,解题关键把握只要反应就不能大量共存的原则,熟记离子反应的条件和离子反应的类型,注意硝酸根离子在酸性环境下表现强的氧化性.

练习册系列答案
 轻松夺冠全能掌控卷系列答案
轻松夺冠全能掌控卷系列答案
相关题目
一定温度下,可逆反应H2(g)+I2(g)?2HI(g)达到限度的标志是( )
| A、H2,I2,HI三种物质的浓度一定相等 |
| B、H2,I2全部反应生成了HI |
| C、H2,I2,HI三种物质的浓度保持不变 |
| D、反应中正反应速率逐渐减小,最后减小为零 |
下列说法或表示正确的是( )
| A、等物质的量的硫蒸气和硫固体分别完全燃烧,后者放出的热量少 |
| B、A、B互为同素异形体,由A转化为B时△H═+119 kJ?mol-1可知B比A稳定 |
| C、对△H<0的化学反应,不需要加热,一定能够自发进行到底 |
| D、在101kPa时,H2燃烧的热化学方程式为2H2(g)+O2(g)═2H2O(l)△H═-571.6kJ?mol-1,则H2在101kPa时的燃烧热为571.6kJ?mol-1 |
下列有关化学用语使用正确的是( )
A、硫原子的原子结构示意图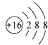 | ||
B、NH4Cl的电子式: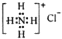 | ||
C、原子核内有10个中子的氧原子:
| ||
| D、基态铜原子的电子排布式为:1s22s22p63s23p63d94s2 |
取质量均为6.5g的两份锌粉a和b,分别加入100mL 2mol/L的稀硫酸中,并向a中加入少量CuSO4溶液,下列说法正确的是( )
| A、a比b 生成氢气的速率快,生成氢气的总量相同 |
| B、b比a 生成氢气的速率快,生成氢气的总量相同 |
| C、a比b 生成氢气的速率快,生成氢气的总量a比b多 |
| D、a比b 生成氢气的速率快,生成氢气的总量a比b少 |
下列说法正确的是( )
①禁用工业酒精配制饮用酒,这是因为工业酒精含甲醇,甲醇又称木醇,有毒
②苯甲酸钠常用作食品防腐剂 ③“来苏水”的有效成分是酚类
④丙三醇可用作内燃机抗冻剂 ⑤葡萄糖和核糖都是六碳糖
⑥牙膏中常添加高级脂肪酸的甘油酯作香料.
①禁用工业酒精配制饮用酒,这是因为工业酒精含甲醇,甲醇又称木醇,有毒
②苯甲酸钠常用作食品防腐剂 ③“来苏水”的有效成分是酚类
④丙三醇可用作内燃机抗冻剂 ⑤葡萄糖和核糖都是六碳糖
⑥牙膏中常添加高级脂肪酸的甘油酯作香料.
| A、①②③ | B、①②⑤⑥ |
| C、④⑤⑥ | D、②③⑥ |
X、Y、Z是原子序数依次增大的短周期主族元素,X2-、Z+都与Mg2+具有相同的核外电子层结构,下列说法中正确的是( )
| A、Y元素位于第二周期第ⅦA族或0族 |
| B、X、Y、Z三种元素中非金属性最强的是X元素 |
| C、X、Y、Z三种元素形成的简单离子的半径都比Mg2+半径小 |
| D、Z分别与X、Y形成的化合物都是离子化合物 |