题目内容
1.下列说法正确的是( )| A. | 氯气的摩尔质量为71 | |
| B. | 将标准状况下11.2L的HCl溶于1.0L的水中,所得溶液中HCl的浓度为0.5mol/L | |
| C. | 常温常压下,等体积的CO和H2的质量比为1:1 | |
| D. | 物质的摩尔质量 (以g.mol-1为单位)在数值上等于其相对分子质量或相对原子质量 |
分析 A.摩尔质量单位g/mol;
B.物质的量浓度中体积为溶液的体积;
C.同温同压相同体积气体具有相同分子数;
D.一种物质的摩尔质量在数值上等于该物质的相对分子质量或相对相对原子质量.
解答 解:A.氯气的摩尔质量为71g/mol,故A错误;
B.将标准状况下11.2L的HCl溶于1.0L的水中,溶液体积不是1.0L,所以HCl的浓度不为0.5mol/L,故B错误;
C.常温常压下,等体积的CO和H2,分子数相同,即物质的量相等,则质量比为1×28:1×2=14:1,故C错误;
D.一种物质的摩尔质量在数值上等于该物质的相对分子质量或相对相对原子质量,但单位不同,故D正确;
故选:D.
点评 本题考查了物质的量的有关计算及对概念的理解,熟悉摩尔质量、阿伏伽德罗定律是解题关键,题目难度不大.

练习册系列答案
相关题目
11.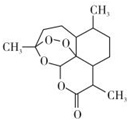 北京时问2015年10月5日,中国女科学家屠哟哟获颁诺贝尔医学奖.屠哟哟从中医古籍里得到启发,用乙醚从青蒿中提取出可以高效抑制疟原虫的成分-青蒿素(结构简式如图),这一发现在全球范围内挽救了数以百万人的生命.下列说法中不正确的是( )
北京时问2015年10月5日,中国女科学家屠哟哟获颁诺贝尔医学奖.屠哟哟从中医古籍里得到启发,用乙醚从青蒿中提取出可以高效抑制疟原虫的成分-青蒿素(结构简式如图),这一发现在全球范围内挽救了数以百万人的生命.下列说法中不正确的是( )
 北京时问2015年10月5日,中国女科学家屠哟哟获颁诺贝尔医学奖.屠哟哟从中医古籍里得到启发,用乙醚从青蒿中提取出可以高效抑制疟原虫的成分-青蒿素(结构简式如图),这一发现在全球范围内挽救了数以百万人的生命.下列说法中不正确的是( )
北京时问2015年10月5日,中国女科学家屠哟哟获颁诺贝尔医学奖.屠哟哟从中医古籍里得到启发,用乙醚从青蒿中提取出可以高效抑制疟原虫的成分-青蒿素(结构简式如图),这一发现在全球范围内挽救了数以百万人的生命.下列说法中不正确的是( )| A. | 青蒿素的分子式为C15H22O5 | |
| B. | 青蒿素能发生取代反应 | |
| C. | 青蒿素属于芳香族化合物 | |
| D. | 用乙醚从青蒿中提取青蒿素,用到了萃取的原理 |
12.有关天然产物水解的叙述不正确的是( )
| A. | 油脂水解可得到丙三醇 | |
| B. | 麦芽糖水解只生成葡萄糖 | |
| C. | 蛋白质水解的最终产物均为氨基酸 | |
| D. | 纤维素水解与淀粉水解得到的最终产物不同 |
9.下列关于钠的说法中,不正确的是( )
| A. | 实验后剩余的钠粒,需要放回原试剂瓶中 | |
| B. | 钠长期放置在空气中,最终将变成碳酸钠 | |
| C. | 钠的化学性质比较活泼,少量的钠可以保存在与钠不反应的煤油中 | |
| D. | 当钠与硫酸铜溶液反应时,有大量红色固体铜出现 |
16.下列表格中各项分类都正确的一组是( )
| 纯净物 | 混合物 | 电解质 | 非电解质 | |
| A | 冰水混合物 | CuSO4•5H2O | 液态KNO3 | 蔗糖 |
| B | CaO | 海水 | 铜 | 酒精 |
| C | 液氯 | 铝合金 | AgCl | CO2 |
| D | 氢氧化钠 | 空气 | Na2SO4溶液 | 食醋 |
| A. | A | B. | B | C. | C | D. | D |
13.表是某地市场销售的一种“加碘食盐”包装袋上的部分文字说明.
(1)由食用方法和贮藏指南可推测碘酸钾的化学性质之一是受热易分解.
(2)已知碘在碘酸钾中的化合价为+5,碘酸钾的化学式为KIO3.
(3)用单质碘(I2)与氯酸钾发生置换反应可制得碘酸钾,该反应的化学方程式为I2+2KClO3=Cl2↑+2KIO3.
| 配 料 | 氯化钠、碘酸钾 |
| 含碘量 | (20mg~40mg)/1kg |
| 保质期 | 18个月 |
| 食用方法 | 勿长时间炖炒 |
| 贮藏指南 | 避热、防潮 |
(2)已知碘在碘酸钾中的化合价为+5,碘酸钾的化学式为KIO3.
(3)用单质碘(I2)与氯酸钾发生置换反应可制得碘酸钾,该反应的化学方程式为I2+2KClO3=Cl2↑+2KIO3.
10.表是元素周期表的一部分.
根据A~G元素在周期表中的位置,用化学式填写空白.
(1)元素中电负性最强的是F,第一电离能最小的是Na.
(2)最高价氧化物对应水化物的酸性最强的酸是HClO4.
(3)D、E、F三种元素按原子半径由大到小的顺序排列为P>N>F.
(4)A的氧化物和B的单质反应后所得溶液的pH>7.
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 1 | A | |||||||
| 2 | D | F | H | |||||
| 3 | B | C | E | G |
(1)元素中电负性最强的是F,第一电离能最小的是Na.
(2)最高价氧化物对应水化物的酸性最强的酸是HClO4.
(3)D、E、F三种元素按原子半径由大到小的顺序排列为P>N>F.
(4)A的氧化物和B的单质反应后所得溶液的pH>7.