题目内容
6.根据要求回答下列有关问题:(1)将红热的铁丝伸入盛有纯净氯气的集气瓶中,反应现象为产生了大量的红棕色的烟,将反应后的产物溶于水配成饱和溶液,并将该溶液分成两份,分别进行如下实验:
(2)向其中一份溶液中加入一小块金属钠,观察到既有无色气泡产生,又有红褐色沉淀生成.则反应过程中发生反应的离子方程式为2Na+2H2O═2Na++2OH-+H2↑、Fe3++3OH-═Fe(OH)3↓;
(3)将另一份滴加到沸腾的水中,会得到红褐色的液体,下列胶体的性质中,可证明该液体为胶体的方法是a(填序号,下同),可去除Fe(OH)3胶体中的离子,净化胶体的是操作为d.
a.丁达尔效应 b.电泳 c.聚沉 d.渗析.
分析 (1)铁丝在氯气中燃烧产生棕红色的烟,可溶性的铁盐溶液呈黄色或棕黄色;
(2)钠和水反应生成氢氧化钠和氢气,氢氧化钠和氯化铁发生反应生成红褐色沉淀,书写方程式;
(3)胶体具有丁达尔效应,胶体中分散质粒子的直径在1-100nm之间;可去除Fe(OH)3胶体中的离子,净化胶体的是操作是渗析,由此分析解答.
解答 解:(1)铁丝在氯气中燃烧生成棕红色的烟,为氯化铁固体,氯化铁为可溶性的铁盐,其水溶液呈黄色或棕黄色,故答案为:产生了大量的红棕色的烟;
(2)向氯化铁溶液加入钠时,钠和水反应生成氢氧化钠和氢气,氢氧化钠和氯化铁发生复分解反应生成红褐色沉淀氢氧化铁,反应方程式分别为:2Na+2H2O=2NaOH+H2↑、FeCl3+3NaOH=Fe(OH)3↓+3NaCl,离子反应为:Fe3++3OH-═Fe(OH)3↓,故答案为:2Na+2H2O═2Na++2OH-+H2↑、Fe3++3OH-═Fe(OH)3↓;
(3)将氯化铁溶液滴加到沸腾的水中,煮沸一会得到红褐色的液体,该液体能产生丁达尔效应,所以为胶体,净化胶体的是操作是渗析,故答案为:a;d.
点评 本题以氯气为载体考查了氯气和铁的反应现象、胶体的性质、钠和氯化铁溶液反应现象、氯气的尾气处理等知识点,根据氯气的性质、胶体的性质、钠的性质来分析解答即可,注意胶体和溶液的本质区别,为易错点.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案 目标测试系列答案
目标测试系列答案
相关题目
16.下列关于强电解质和弱电解质的下列叙述中正确的是( )
| A. | 强电解质和弱电解质的本质区别在于:强电解质易溶于水,弱电解质 难溶于水 | |
| B. | 强电解质都是可溶性化合物,弱电解质都是难溶性化合物 | |
| C. | 强电解质的水溶液中无溶质分子,弱电解质的水溶液中有溶质分子 | |
| D. | 强电解质溶液的导电能力强,弱电解质溶液的导电能力弱 |
14.下列说法中,不正确的是( )
| A. | 胶体与溶液的本质区别是丁达尔效应 | |
| B. | 氯化铁溶液可应急止血,利用的是胶体的聚沉 | |
| C. | 用一束平行光线入射淀粉溶液里,从侧面可以观察到一条光亮的通路 | |
| D. | 将稀硫酸逐滴加入氢氧化铁胶体中,开始时产生沉淀,继续滴加时沉淀又溶解 |
1.下列说法正确的是( )
| A. | 氯气的摩尔质量为71 | |
| B. | 将标准状况下11.2L的HCl溶于1.0L的水中,所得溶液中HCl的浓度为0.5mol/L | |
| C. | 常温常压下,等体积的CO和H2的质量比为1:1 | |
| D. | 物质的摩尔质量 (以g.mol-1为单位)在数值上等于其相对分子质量或相对原子质量 |
11.下列离子方程式改写成化学方程式正确的是( )
| A. | Cu2++2OH-=Cu(OH)2↓CuCO3+2NaOH═Cu(OH)2↓+Na2CO3 | |
| B. | CO32-+2H+=CO2↑+H2OBaCO3+2HCl═BaCl2+CO2↑+H2O | |
| C. | Ca2++CO32-=CaCO3↓Ca(NO3)2+Na2CO3═CaCO3↓+NaNO3 | |
| D. | H++OH-=H2OBa(OH)2+H2SO4═BaSO4↓+2H2O |
18.如图所示,自行车各部件防腐措施不恰当的是( )


| A. | 涂机油 | B. | 烤漆 | C. | 镀锌 | D. | 镀铬 |
15.如图为铜-锌-稀硫酸构成的原电池示意图,下列说法错误的是( )
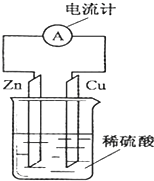

| A. | 电子由铜片通过导线流向锌片 | |
| B. | 铜为正极,铜不易失电子而受到保护 | |
| C. | 锌片为负极,且锌片逐渐溶解 | |
| D. | 该装置能将化学能转变为电能 |
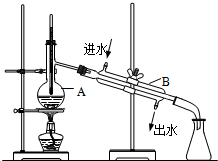 如图为实验室制取蒸馏水的装置示意图,根据图示回答下列问题.
如图为实验室制取蒸馏水的装置示意图,根据图示回答下列问题.